8 Minutės
Tyrėjai iš Northwestern Medicine atskleidė slaptą mechanizmą, leidžiantį kasos navikams išsisukti nuo imuninės atakos, ir sukūrė antikūną, kuris pelių modeliuose gali atkurti pažeistą imuninį atpažinimą. Šis atradimas parodo, kaip cukraus signalas – paprastai naudojamas sveikų ląstelių – yra perimtas vėžio, kad užčiauptų imuninės sistemos veikimą, ir nurodo naują kryptį terapijoms prieš vieną mirtiniausių vėžio formų. Straipsnyje aptariama kasos vėžio imunologija, sialinės rūgšties vaidmuo, integrino α3β1 modifikacija, Siglec‑10 receptoriaus įsijungimas bei terapinė strategija su monoklonaliniais antikūnais.
How pancreatic tumors hide from the immune system
Kasos vėžys yra žinomas kaip itin atsparus gydymui. Daugeliu atvejų jis diagnozuojamas vėlai, o penkerių metų išgyvenamumas siekia tik apie 13 %, todėl pacientų prognozė išlieka prasta. Be to, kasos navikai dažnai atsparūs šiuolaikinėms imunoterapijoms, kurios veiksmingos kitų tipų navikams. Tyrėjai jau seniai įtarė, kad naviko mikroaplinka aktyviai slopina imuninę veiklą, tačiau tikslios molekulinės gudrybės, kuriomis navikai naudojasi, ilgai išliko neaiškios.
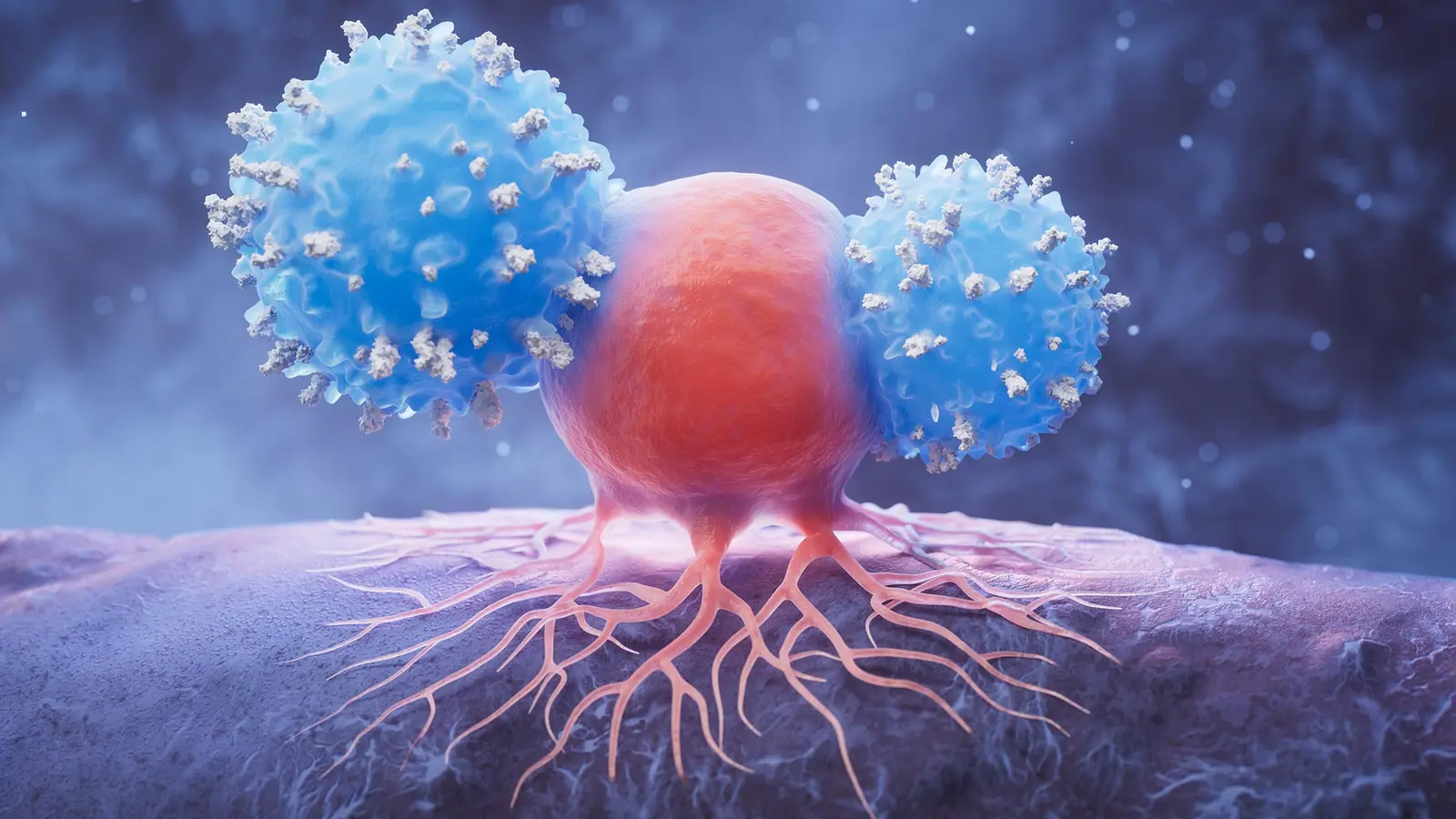
Northwestern komanda nustatė, kad kasos naviko ląstelės išnaudoja natūralų ląstelių žymeklį – sialinę rūgštį (angl. sialic acid) – kurią sveikos ląstelės rodo ant savo paviršiaus kaip signalą „nekenk man“ imuninėms ląstelėms. Navikas prijungia sialinę rūgštį prie konkretaus paviršinio baltymo, integrino α3β1. Toks sialinuotas integrinas vėliau prisijungia prie imuninėse ląstelėse esančio receptoriaus, žinomo kaip Siglec‑10. Siglec‑10 aktyvacija perduoda inhibicinį signalą, tarsi nurodydama imuninėms ląstelėms atsitraukti ir susilpninti jų atsaką prieš navikines ląsteles.
Gali būti sakoma paprastai: vėžys apsirėdo molekuline kauke. Imituodamas normalių ląstelių cukrinį apvalkalą, navikas paverčia apsauginį signalą į skydą, blokuojantį imuninį stebėjimą ir efektorių funkcijas. Šis mechanizmas leidžia navikui išvengti tiek įgimtos, tiek adaptuotos imuninės sistemos poveikio – nuo makrofagų ir dendritinių ląstelių aktyvavimo iki T ląstelių atpažinimo ir naikinimo. Tokia maskuotė turi rimtų pasekmių naviko progresijai, metastazavimui ir atsakui į gydymą.

Tyrimo autoriai Abdel‑Mohsen ir Pratima Saini Abdel‑Mohsen laboratorijoje Northwestern University Feinberg medicinos mokykloje Čikagoje.
Designing an antibody to break the sugar shield
Kai mokslininkai susiejo imuninį slopinimą su sialinės rūgšties–integrino α3β1–Siglec‑10 ašimi, jie ėmėsi kurti monoklonalinius antikūnus, galinčius nutraukti šį sąveikos grandinę. Tokios klasės antikūnų kūrimas reikalavo plataus ekrano – tūkstančiai hybridomų buvo išanalizuoti, kol buvo atrinkti kandidatai, patikimai blokuojantys naviko cukrinę kamufliažą laboratoriniais tyrimais be akivaizdžių nepageidaujamų off‑target efektų. Šio proceso metu buvo naudojami tiek biocheminiai, tiek ląsteliniai testai, įvertinant antikūnų afinitetą, specifiškumą ir gebėjimą konkuruoti su Siglec‑10 ryšiu.
Pelės kasos vėžio modeliuose gydymas blokuojančiu antikūnu atgaivino imuninį atsaką. Imuninės ląstelės ėmė atpažinti ir sunaikinti navikines ląsteles, o gydytų gyvūnų navikų augimas buvo reikšmingai lėtesnis nei kontrolinei grupei. Šie priešklinikiniai rezultatai pateikia aiškų koncepcijos įrodymą: jei nutraukiama sialinė‑Siglec sąveika, vietinis imuninės slopinimo fenotipas gali būti apverstas. Be to, tyrimo duomenys atskleidžia įdomių užuominų apie tai, kaip tokie antikūnai gali sinergizuoti su kitais imunoterapiniais agentais arba skatinančiomis imunines funkcijas strategijomis.

Tyrimo vyresnysis autorius Mohamed Abdel‑Mohsen savo laboratorijoje Northwestern University Feinberg medicinos mokykloje Čikagoje.
Scientific context and relevance
Gliko‑imunologija – sritis, tirianti, kaip angliavandeniai moduliuoja imuninę funkciją, – yra sparčiai besivystanti mokslo sritis. Sialinės rūgštys yra tik viena gliukanų klasė, darančių įtaką ląstelių tarpusavio komunikacijai ir imuninės sistemos atpažinimui. Northwestern komandos atradimas pateikia konkretų pavyzdį, kaip gliukano modifikacija konkrečiam integrinui gali pakeisti mikroaplinką iš imunostimuliuojančios į imunoslopinančią, o tai turi praktinių pasekmių terapijų kūrimui.
Molekulinių detalių supratymas yra kertinis elementas projektuojant efektyvias terapijas. Pvz., kontrolinių taškų (checkpoint) inhibitoriai, taikantys PD‑1/PD‑L1 kelią, veikia atlaisvindami T ląstelių „stabdžius“, tačiau jie gali neapimti alternatyvių slopinimo maršrutų, kuriuos mediavo Siglec receptoriai. Naujas antikūnas taikosi į kitokio tipo imuninį „stabdį“ – cukraus atpažinimo kelią – todėl jis yra perspektyvus kandidatas deriniams su esamomis imunoterapijomis ir chemoterapija. Tokia kombinacija gali padidinti naviko apčiuopiamumo ribą ir pratęsti remisijos trukmę.
„Mūsų komandai užtruko maždaug šešeri metai, kol atradome šį naują mechanizmą, sukūrėme tinkamus antikūnus ir juos patikrinome“, – sakė Mohamed Abdel‑Mohsen, vidaus ligų asocijuotas profesorius, užkrečiamųjų ligų skyriuje Northwestern University Feinberg medicinos mokykloje. „Pamatyti, kad tai veikia, buvo didelis proveržis.“ Jo komentaras taip pat atkreipia dėmesį į ilgą ir sudėtingą užnugarį, reikalingą nuo koncepcijos prie priešklinikinės sėkmės, įtraukiant bioinformatiką, molekulinę biologiją ir gyvūnų modelius.

Tyrimo autoriai Abdel‑Mohsen ir Pratima Saini aptaria rezultatus Abdel‑Mohsen laboratorijoje Northwestern University Feinberg medicinos mokykloje Čikagoje.
From bench to bedside: next steps and timelines
Po sėkmingų priešklininių eksperimentų tyrėjų komanda optimizuoja antikūną, kad būtų užtikrintas jo saugumas ir tinkamas dozavimas žmonėms. Tyrėjai taip pat tiria derinius, kuriuose cukrą blokuojantis antikūnas jungiamas su chemoterapija ir esamomis imunoterapijomis, siekdami nustatyti, ar kombinuotos schemos gali sukelti gilias ir ilgaamžes remisijas nei atskiri agentai. Kiekvienas derinys reikalauja kruopštaus priešklinikinio vertinimo dėl potencialaus toksinio poveikio bei sinergijos ar antagonizmo tarp vaistų.
Kitas praktinis elementas yra pacientų atranka. Komanda kuria palydovinį diagnostinį testą (companion diagnostic), skirtą aptikti navikus, kurie priklauso nuo sialinės rūgšties–Siglec‑10 kelio, kad klinikai galėtų identifikuoti pacientus, greičiausiai gavusius naudos. Tokia diagnostika galėtų įtraukti histocheminius žymenis, masinės spektrometrijos profiliavimą arba tikslines antikūnų pagrindu veikiančias imunofluorescencines metodikas. Abdel‑Mohsen prognozuoja, kad jei plėtra ir ankstyvieji klinikiniai tyrimai vyks sklandžiai, žmogaus terapija galėtų būti pasiruošusi platesniems klinikiniams tyrimams maždaug per penkerius metus.
Be kasos vėžio, mokslininkai tiria, ar ta pati cukrinio apvalkalo strategija gali veikti kituose sunkiai gydomuose navikuose, pavyzdžiui, glioblastomoje, o taip pat ir ne piktybinėse ligose, kuriose imuninės slopinimas yra požymis (pvz., kai kurios autoimuninės ar uždegiminės būklės su specifinėmis lokalizacijomis). Išvada yra plačių apimčių: nukreipiant gliukanų mediaciją atliekamus imuninės kontrolės taškus, galima išplėsti imunoterapijos įrankių rinkinį ir sukurti naujas strategijas pacientams, anksčiau mažai reagavusiems į gydymą.
Expert Insight
Dr. Elena Morales, imunologė, tyrinėjanti naviko mikroaplinką, komentavo: „Šis straipsnis atkreipia dėmesį į menkai įvertintą imuninės reguliacijos sluoksnį. Gliukanų mediatoriami signalai gali būti tokie pat reikšmingi kaip baltymų pagrindu veikiantys kontroliniai taškai. Vertimas to į saugų, veiksmingą žmogaus antikūną bus sudėtingas, tačiau požiūris žada daug, nes jis atakuoja ortogoninį imunoslopinimo mechanizmą.“
Ji pridūrė: „Palydovinis diagnostinis testas yra būtinas – ne kiekvienas navikas remsis cukraus‑Siglec ašimi. Jei tinkami pacientai bus atrinkti ir derinimo strategijos bus kruopščiai suprojektuotos, tai gali būti svarbus žingsnis vėžiams, kurie iki šiol buvo beveik atsparūs šiuolaikinei imunoterapijai.“ Šis ekspertų komentaras pabrėžia, kad tikslinė pacientų atranka ir individualizuoti gydymo planai yra esminiai sėkmingam tokio tipo terapijos taikymui klinikoje.
Implications and outlook
Northwestern atliktas tyrimas pateikia aiškų mechanistinį supratimą ir terapinę strategiją, kuri papildo esamus metodus. Atskleidus, kaip integrino α3β1 sialinė dekoracija aktyvina Siglec‑10 ir slopina imuninę reakciją, bei parodyta, kad antikūnai gali blokuoti šį signalą in vivo, darbas atveria naują frontą kovoje su imunoterapijai atspariais navikais. Tokios strategijos vystymas gali turėti plataus masto poveikį klinikinių protokolų kūrimui, biomarkerių paieškai ir personalizuotos medicinos diegimui onkologijoje.
Pagrindiniai raktiniai žodžiai tolesniems tyrimams ir klinikinei vertimui apima: kasos vėžys, sialinė rūgštis, Siglec‑10, monoklonalinis antikūnas, imunoterapija ir glikoinimunologija. Keli etapai laukia ateityje: kruopštus saugumo ištyrimas, racionaliai suplanuoti kombinaciniai tyrimai bei patikimi biomarkeriai, kurie susies pacientus su gydymu, kuriam jie yra jautriausi. Taip pat svarbu kaupti daugialypes duomenų bazes ir tarptautines bendradarbiavimo iniciatyvas, kurios gali paspartinti atradimų vertimą į kliniką.
Conclusion
Nukreipti dėmesį į cukrinį apvalkalą, kuris slepia kasos navikus, siūlo naują strategiją stiprinti priešnavikinę imuninę reakciją. Nors klinikinė prieinamumas vis dar gali užtrukti kelerius metus, priešklinikinė sėkmė pateikia stiprų pagrindą skatinti antikūno vystymą link žmogaus tyrimų, o tai gali praplėsti gydymo galimybes pacientams, sergantiems anksčiau mažai valdomais vėžiais. Tolimesni žingsniai apima saugumo optimizavimą, diagnostinių testų kūrimą ir kruopščiai paruoštus klinikinius pakopinius tyrimus, kurie kartu siektų išversti šį mechanistinį atradimą į realų klinikinį efektą.
Šaltinis: scitechdaily

Palikite komentarą