6 Minutės
Nauja hibridinė imuninė ląstelių terapija visiškai užkirsti kelią ir atstatė 1 tipo diabetą pelėms be ilgalaikės imunosupresijos, teigia Stanfordo medicinos mokyklos mokslininkai. Sukūrę mišrų imuninį sistemą, kurioje yra tiek donorinių, tiek recipiento ląstelių, tyrėjų komanda atstatė insuliną gaminančias kasos saleles ir sustabdė autoimuninį išpuolį, sukeliančią ligą. Šis metodas derina kasos salelių transplantaciją su hematopoetinių kamieninių ląstelių įvedimu ir sąlygoja antigenui specifinę imuninę toleranciją, kuri leidžia transplantuotoms beta ląstelėms funkcionuoti be nuolatinės imunosupresijos.
Why this approach matters: resetting the immune system and replacing islets
1 tipo diabetas yra autoimuninė liga, kurioje organizmo imuninė sistema klaidingai atpažįsta kasos beta salelių (beta ląstelių) struktūras kaip svetimkūnius ir jas sunaikina. Kai šios beta ląstelės prarandamos arba smarkiai sumažėja, insuliną gaminančių ląstelių kiekis krenta, insulino sekrecija žlunga, ir gliukozės homeostazė sutrinka, todėl atsiranda hiperglikemija bei kitos metabolinės komplikacijos. Tradicinės kasos salelių transplantacijos (kasos salelių transplantacija) gali atkurti insulino gamybą ir normalizuoti gliukozės kontrolę, tačiau transplantuotos salelės dažnai patenka į tą patį autoimuninį „fokusą“ ir gresia jų atakos rizika. Dėl to pacientams dažnai reikia gyventi su nuolatine imunosupresija, kuri mažina imuninės atakos riziką, bet kartu didina infekcijų, navikų ir kitų komplikacijų riziką.
Stanfordo komanda pasirinko kitokį kelią: vietoj to, kad vien tik pakeistų prarastas saleles, jie pasiruošė recipiento imuninę sistemą taip, kad ji galėtų priimti donorines imuninės kilmės ląsteles ir veikti subalansuotai kartu su jomis. Jų hibridinė strategija sujungia kraują formuojančias (hematopoetines) kamienines ląsteles bei donorines kasos saleles su specialiu kondicionavimo protokolu, kuris švelniai „perkrauna“ recipiento imuninę sistemą. Tokiu būdu susiformuoja chimerinė arba hibridinė imuninė sistema, kurioje kartu egzistuoja recipiento ir donorinės kilmės imuninės ląstelės, o imuninė tolerancija transplantuotoms salelėms išlieka be nuolatinės imunosupresijos. Šis požiūris išsprendžia abi pagrindines 1 tipo diabeto sąlygas: trūkstamų beta ląstelių atkūrimą ir autoimuninės atakos prevenciją.
How the experiment worked: conditioning, transplant and tolerance
Tyrime priešdiabetinės ir diabetinės pelės gavo trumpą kondicionavimo protokolą: trumpą imuninį slopintoją, mažiausią arba žemo lygio radiacijos kursą ir parinktines monoklonines antikūnus, skirtas sumažinti tam tikras imuninės populiacijas, tačiau nepalikti organizmo visiškai imunodepresuotam. Toks dalinis kondicionavimas sumažino agresyvių autoreaktyvių ląstelių kiekį ir sudarė erdvę donorinėms hematopoetinėms kamieninėms ląstelėms prigyti. Kartu su tuo recipientams buvo įvestos donorinės kraujo kamieninės ląstelės ir sveikos donorinės kasos salelės, kurios buvo implantuotos tam tikroje vietoje, kad atstatytų insulino gamybą.
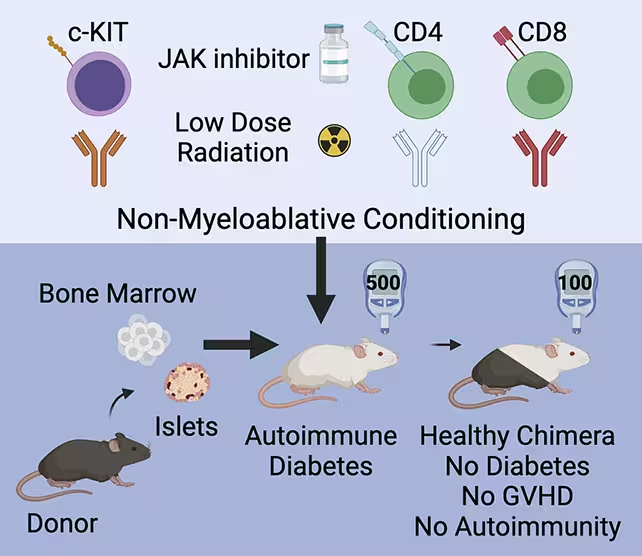
Gyvūnams buvo suteiktas kondicionavimo gydymas, pasiruošiant jų imunitetui ląstelių transplantacijai.
Toks švelnus kondicionavimas leido donorinėms kamieninėms ląstelėms įsiskverbti į recipiento kaulų čiulpus ir generuoti donorinės kilmės imuninės sistemos fragmentą, kuris kartu egzistavo su šeimininko imuninėmis ląstelėmis. Ši koegzistencija sukūrė stabilų imuninį balansą — nebuvo pastebėta tipiškos graft-versus-host ligos (GvHD), kuri dažnai pasireiškia, kai vieno asmens ląstelės imunologiškai puola kitą organizmą. Vietoje šios destruktyvios reakcijos susiformavo kontroliuojama chimerizacija, o išaugusios tolerancijos mechanizmai leido transplantuotoms kasos salelėms išlikti funkciškoms. Rezultatas: transplantuotos beta ląstelės buvo apsaugotos, jų funkcija atsigavo, o gliukozės kiekis kraujyje normalizavosi pelėms, kurios jau sirgo 1 tipo diabetu; tuo pačiu metu procedūra užkirto kelią ligai pelėms, kurios buvo padidintos rizikos stadijoje (prediabetinėse).
Key results and scientific implications
Rezultatai yra įspūdingi: terapija užkirto kelią diabetui pelėms, esančioms didelės rizikos grupėje, ir atstatė pilną ligą kitose pelėse. Svarbu pažymėti, kad nė vienas iš gydytų gyvūnų per stebėjimo laikotarpį neparodė graft-versus-host ligos požymių, imuninė funkcija apskritai grįžo į įprastą lygį išskyrus specifinę toleranciją donorinėms kasos salelėms. Tik nedidelė dalis transplantuotų salelių parodė lengvą uždegiminę reakciją, bet jos nebuvo sunaikintos — tai teigiamas ženklas, kad veikė tolerancijos mechanizmai, o ne pločio mastu atliekama imuninis slopinimas.
Vyresnysis autorius Seung Kim iš Stanfordo apibūdino šį požiūrį kaip transformuojantį ir pasiūlė, kad panašios hibridinės strategijos galėtų būti pritaikytos ir kitoms autoimuninėms ligoms bei kietųjų organų transplantacijoms. Donorinių ir recipiento imuninės ląstelės maišyti siekiant indukuoti toleranciją nėra visiškai nauja idėja — ankstesni transplantacijos tyrimai, įskaitant šios grupės ankstesnius darbus, jau demonstravo šios sąvokos galimybes. Vis dėlto šios strategijos pritaikymas 1 tipo diabetui, kartu su kasos salelių pakeitimu, žymi svarbų žingsnį į priekį, nes efektyviai sprendžiamos tiek ląstelių trūkumo, tiek autoimuninio sunaikinimo problemos.
Challenges ahead: supply, scaling and human translation
Nors rezultatai žada daug, prieš neišvengiamą perėjimą prie žmonių klinikinių tyrimų dar lieka reikšmingų iššūkių. Donoruotos žmogaus kasos salelės yra retos ir dažniausiai pasiekiamos tik po mirties, todėl klinikiniai protokolai turi suderinti donorinių salelių gavimą su atitinkamomis kraujodaros kamieninėmis ląstelėmis, kad hibridinė strategija veiktų taip, kaip suplanuota. Be to, reikia užtikrinti transplantuotų ląstelių ilgaamžiškumą ir išvengti ankstyvo jų netekimo dėl neimunologinių priežasčių, pavyzdžiui, aterotrombozės, nepakankamo kraujotakos prisotinimo ar hipoksijos vietoje, kuriose implantuojamos salelės.
Kiti neatsakyti klausimai apima optimalų donorinių kamieninių ir kasos salelių kiekį, tikslią kondicionavimo regimeną, kuri geriausiai subalansuoja veiksmingumą ir saugumą, bei ilgalaikį tolerancijos išliekamumą. Mokslininkai taip pat tiria, ar kasos saleles būtų praktiška ir etiška masiškai generuoti laboratorijoje iš pluripotentinių kamieninių ląstelių (iPSC arba ESC) tam, kad būtų sukurtas patikimas ir pakankamas tiekimas. Tokie laboratoriniai šaltiniai galėtų sumažinti priklausomybę nuo donorų organų ir suteikti galimybę pritaikyti kasos saleles pagal recipiento imuninį profilį, tačiau tai reikalauja papildomų tyrimų, kad būtų patikimai užtikrintas jų saugumas ir funkcionalumas.
Expert Insight
„Dvikryptė strategija, kuri kartu pakeičia prarastas beta ląsteles ir permiežia imuninę sistemą, sprendžia abi problemos pamatiniu lygiu,“ teigia dr. Laura Chen, imunologė ir transplantacijos tyrėja, nedalyvavusi šiame tyrime. „Jeigu hibridinis imuninės sistemos būsena pasitvirtins ir bus stabili žmonėms, tai gali sumažinti arba net pašalinti būtinybę nuolatiai vartoti imunosupresantus — tai būtų milžiniškas klinikinis pranašumas.“
Autoriai yra atsargūs, bet optimistiški. Jie pabrėžia, kad nors dabartiniai rezultatai dar negali būti tiesiogiai pritaikyti žmonėms, mechanistinė koncepcija — kontroliuojamo chimerizmo sukūrimas antigenui specifiškai tolerancijai inducijuoti — jau egzistuoja klinikinėje praktikoje kitoms būklėms gydyti. Tai reiškia, kad tam tikri pagrindiniai klinikiniai žingsniai, reikalingi hibridinių imunitetų sukūrimui, jau yra pritaikyti ir gali pagreitinti klinikinių tyrimų projektavimą pacientams, sergantiems 1 tipo diabetu.
Dabar šis tyrimas žymi prasmingą pažangą: laboratorinę demonstraciją, kad autoimunitetą ir ląstelių pakeitimą galima spręsti kartu, koordinuotai. Kelias iki žmogaus tyrimų reikalauja logistikos ir biologinių mįslių sprendimo, įskaitant donorų audinių prieinamumą, skalavimo problematiką, saugumo užtikrinimą ir ilgalaikės tolerancijos stebėjimą. Tačiau galimybė sukurti potencialiai gydančią strategiją 1 tipo diabetui tapo akivaizdžiai artimesnė, ir tai atveria naujas perspektyvas ląstelinei terapijai, imuninei tolerancijai ir transplantacijos medicinai apskritai.
Šaltinis: sciencealert

Palikite komentarą