8 Minutės
Tyrėjų grupės iš MIT ir Stanfordo sukūrė naują vėžio imunoterapijos metodą, kuris neutralizuoja cukraus pagrindu veikiančią molekulinę „stabdį“ ant navikinių ląstelių, tad imuninė sistema gali aptikti ir sunaikinti anksčiau nuo jos slėptus navikus. Ši strategija naudoja inžinierinius hibridinius baltymus, vadinamus AbLec (lektinu susietos antikūnais), kurie blokuoja glikanų tarpininkaujamas signalines grandines, slopinančias imuninį aktyvumą. Tokia vėžio imunoterapija – specifinis, tikslinis imunomoduliacinis požiūris – atveria galimybes papildyti esamus checkpoint inhibitorius ir spręsti atvejus, kur PD-1/PD-L1 blokadai būna nepakankamai efektyvi.
Kodėl glikanai svarbūs: paslėpti cukraus signalai ant vėžio ląstelių
Glikanai yra sudėtingos cukrinės struktūros, dengiančios praktiškai kiekvieną organizmo ląstelę. Vėžys pakeičia šį cukrinį apvalkalą: navikinės ląstelės dažnai ekspresuoja neįprastus glikanus, turinčius daug sialo rūgšties (sialinių liekanų). Šie sialo rūgšties turintys glikanai sąveikauja su lektinų tipo receptoriais imuninėse ląstelėse, žinomais kaip Siglec (sialo rūgšties prijungiantieji Ig tipo lektinai), ir aktyvina imunossupresinį kelią, veikiantį kaip „stabdis“ prieš priešnavikines imuninės atsakas. Tokia glikano–Siglec sąveika gali slopinti makrofagų fagocitozę, natūraliųjų žudikų (NK) ląstelių citotoksiškumą ir kitų imuninės sistemos efektorių aktyvumą, todėl navikai išvengia imuninės kontrolės.
Šiuolaikiniai checkpoint inhibitoriai – vaistai, blokuojantys PD-1 arba PD-L1 – atlaisvina vieną imuninės slopinimo mechanizmų klasę ir kai kuriems pacientams lėmė ryškius ir ilgalaikius remisijų rezultatus. Tačiau daugelis navikų rodo atsparumą šioms terapijoms arba turi alternatyvių imuninio paslėpimo kelių. Siglec–sialo rūgšties ašis funkcionaliai yra alternatyvus „checkpoint“ mechanizmas: kai Siglec receptoriai prisijungia prie sialo rūgšties turinčių glikanų ant vėžio ląstelių, tiek įgimtosios (makrofagai, NK ląstelės), tiek adaptacinės imuninės reakcijos gali būti reikšmingai slopinamos. Todėl glikanai ir Siglec receptoriai yra svarbios taikinimo vietos, kai siekiama išplėsti imunoterapijos efektyvumą ir pasiekti anksčiau neatsakančius pacientus.
Kaip veikia AbLecs: lektinų „perėmimas“ naudojant antikūnus
Pagrindinė MIT ir Stanfordo komandų inovacija yra modulinis baltymas, kurį jie pavadino AbLec. Kiekvienas AbLec sujungia lektino tipo domeną, galintį prisijungti prie sialo rūgšties turinčių glikanų, su antikūno „ranka“, atpažįstančia navikui būdingą antigeną. Antikūnas nukreipia ir koncentruoja lektino domeną ant navikinės ląstelės paviršiaus, kur šis domenas konkuruoja su imuninėse ląstelėse esančiais Siglec receptoriais dėl sialo rūgšties prijungimo. Tokiu būdu vietoje, kur yra navikas, susidaro glikano blokada, neleidžianti Siglec receptoriams susieti su sialo rūgšties motifais ir inicijuoti slopinimo signalų, todėl imuninės ląstelės gali atnaujinti savo priešnavikinę veiklą.
Iš silpno prisijungėjo – į veiksmingą blokatorių
Lektinų domenai pavieniui dažnai prisijungia silpniau ir nesikaupia pakankamai efektyviai ant navikinių ląstelių paviršiaus, todėl jų farmakodinaminis poveikis bus ribotas. Priešingai, antikūnai pasižymi aukštu afinitetu naviko antigenams ir gali lokalizuotis prie navikų didelėmis koncentracijomis. Sujungus lektiną su antikūnu gaunamas abiejų komponentų privalumų sinerginis efektas: tikslingas pristatymas ir vietinė glikanų blokada. Tokia kombinacija sukuria vietinį „pagalbinį spąstą“ (decoy), kuris užkerta kelią imuninį slopinimą vykdančiai Siglec sąveikai ir išlaisvina imuninės sistemos efektorius atakuoti naviką. Be to, tokia konstrukcija leidžia valdyti vietinę koncentraciją ir avidumą, vengiant bendro organizmo ekspozicijos, kuri gali sukelti pašalinį poveikį.
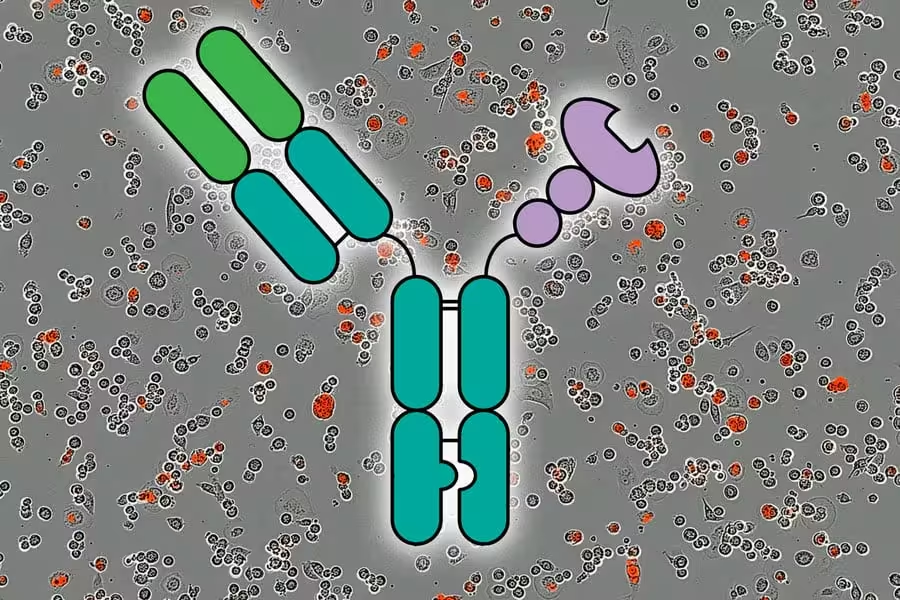
Tyrėjai parodė, jog galima sustiprinti priešnavikinę imuninę reakciją naudojant molekules, vadinamas AbLec (vaizduojamas centre), kurios slopina imuninį „checkpointą“. Foną sudaro raudona fluorescencija, žyminti per 5 valandas sunaikintas vėžio ląsteles. Kreditai: Tyrėjų mandagumas; MIT News. Ši vizualizacija akcentuoja ne tik molekulinį mechanizmą, bet ir greitą ląstelinį poveikį, kurį matavo in vitro sistemose naudodami gyvybingumo ir ląstelių žūties žymenis.
Preklinikiniai įrodymai: nuo ląstelių iki humanizuotų pelių
Siekiant patvirtinti koncepciją, komanda sukonstravo AbLec naudodama trastuzumabą (anti-HER2 antikūną) kartu su lektino domenu, gautu iš Siglec-7 arba Siglec-9. Ląstelių pagrindu atlikti tyrimai parodė, kad šie AbLeciai perprogramavo imuninės sistemos ląsteles taip, jog jos atakavo HER2 teigiamas navikines ląsteles efektyviau nei vien tik trastuzumabas. Be to, naudojant pelių modelį, genetiškai modifikuotą taip, kad ekspresuotų žmogaus Siglec receptorus ir žmogaus antikūnams jautrius receptorius, AbLec gydymas sumažino plaučių metastazių skaičių palyginti su vien tik trastuzumabo terapija. Tokie rezultatai rodo, kad AbLecs gali aktyvinti tiek įgimtosios, tiek adaptacinės imuninės grandys, kurios ankščiau buvo slopinamos glikano–Siglec sąveikų.
Šie preklinikiniai duomenys yra reikšmingi dėl kelių priežasčių: jie įrodo, kad imuninio atsako „atsarginių stabdžių“ atjungimas per glikanų blokadą gali atleisti makrofagus ir NK ląsteles, taip pat sustiprinti T ląstelių atsaką per antigeno apdorojimą ir kryžminį pristatymą. Be to, AbLec strategija sumažino naviko apkrovą tose situacijose, kur standartinė antikūnų terapija turėjo ribotą poveikį, pavyzdžiui, sergant navikais su dideliu glikanų remodeliavimu ar padidėjusiu sialo rūgšties ekspresavimu.
Modulinis dizainas: plug-and-play platforma
Viena perspektyviausių AbLec savybių yra jų moduliškumas. Antikūno „ranka“ gali būti keičiama, kad taikytųsi į skirtingus naviko antigenus – pavyzdžiui, rituksimabas (anti-CD20) galėtų būti naudojamas B ląstelių vėžio atvejais, o cetuksimabas (anti-EGFR) – tam tikrose kietųjų navikų rūšyse. Panašiai lektino domeną galima pakeisti, kad tiksliau taikytųsi į skirtingus glikaninius motivus arba į skirtingus lektinų receptorių šeimos narius. Tokia plug-and-play koncepcija atveria plataus pritaikymo galimybes: individualizuotos terapijos konkrečioms vėžio rūšims, kombinacijos su kitomis imunoterapijomis arba sinergiški deriniai su chemoterapija ir radioterapija.
Kadangi daugelis navikų tipų remiasi glikano pagrindu veikiančiu imuninės slopinimo mechanizmu, AbLecs galėtų papildyti esamus checkpoint inhibitorius arba būti skiriami pacientams, kurie neatsako į PD-1/PD-L1 blokadą. Be to, jų lankstumas leidžia taikyti kelis imunossupresinius glikaninius motyvus, kurie gali išsivystyti skirtinguose navikuose arba skirtinguose ligonių pogrupiuose. Tokia strategija suteikia galimybę kurti daugiakomponentes, daugiafunkcines molekules arba derinius, kurie adresuotų kelis imuninės slopinimo mechanizmus vienu metu.
Iššūkiai ir tolesni žingsniai
Vis dėlto svarbūs iššūkiai išlieka prieš tai, kol AbLeciai pasieks kliniką. Navikams būdingi glikanai kartais gali būti išreikšti ir sveikose audiniuose mažesniu lygiu, todėl kyla klausimų dėl off-target poveikio ir saugumo. Be to, imuninė sistema pati gali reaguoti į naujus baltymų konstrukcijas, todėl imunogeniškumas, neutralizuojančių antikūnų susidarymas ir tinkamos dozavimo strategijos privalo būti kruopščiai ištirti ankstyvuosiuose tyrimuose. Sudėtingų hibridinių baltymų gamyba dideliais mastais, stabilumo užtikrinimas ir kainodaros valdymas yra papildomi praktiniai iššūkiai, susiję su tolimesne komercializacija.
Vertinant translaciją į žmogaus gydymą, reikalingi kruopščiai suprojektuoti klinikiniai tyrimai, kurie išmatuotų AbLec veiksmingumą, toleruojamumą ir galimybę praplėsti pacientų grupę, gaunančią naudą iš imunoterapijos. Preklinikiniai rezultatai pateikia pagrindą pereiti prie žmogaus tyrimų, tačiau tik gerai struktūrizuoti fazės I/II klinikiniai tyrimai galės nustatyti tikrąją klinikinę vertę, optimalų dozių režimą, derinius su kitomis terapijomis ir saugumo profilį ilgalaikėje perspektyvoje.
Eksperto įžvalga
„Taikinant glikanų kraštovaizdį atsiveria elegantiškas būdas išplėsti imunoterapiją,“ sako dr. Elena Morales, imunoonkologė, nedalyvavusi tyrime. „AbLecs išradingai sprendžia pristatymo problemą – jie paverčia silpnus glikanų jungėjus į stiprius, navikui lokalizuotus blokatorius. Jeigu saugumas ir specifika pasitvirtins klinikiniuose tyrimuose, tai gali tapti svarbiu PD-1/PD-L1 inhibitorių papildymu.“ Ši nuomonė pabrėžia, kad pagrindinis AbLec privalumas – tikslus pristatymas ir funkcionalus vietinis poveikis – gali papildyti bendrą imunoterapijos arsenalo efektyvumą, ypač sudėtingose, glikanams priklausančiose navikų biologinėse situacijose.
Pasekmės pacientams ir terapijoms
Pacientams AbLec technologija žada du pagrindinius privalumus: pirmiausia – galimybę įveikti anksčiau netaikytą imuninio išvengimo mechanizmą; antra – lankstumą pritaikyti terapiją prie skirtingų navikų antigenų ir glikanų tikslų. Tai reiškia, kad teoriškai platesnė vėžio dalis galėtų tapti jautri imuninėms terapijoms arba kad galima būtų pasiūlyti individualizuotas terapijas, pritaikytas konkrečios ligos glikanų ekspresijos profiliui. Klinikinėje praktikoje tai gali reikšti didesnį gydymo pasirinkimų spektrą pacientams, kurie iki šiol neturėjo veiksmingų imunoterapinių alternatyvų.
Praktiškai gydytojams ir tyrėjams teks apibrėžti biomarkers rinkinius, prognozuojančius, kurie navikai yra varomi sialo rūgšties–Siglec sąveikų. Tai apima audinių imunohistocheminius tyrimus, masyvos analizę glikanų profiliavimui, sialiltransferazių ekspresijos vertinimą ir Siglec receptorių išraiškos matavimus. Pacientų atranka, derinių režimų formulavimas bei saugumo monitoringo strategijos bus lemtingi, kaip AbLeciai bus integruojami į esamą gydymo taktiką kartu su checkpoint inhibitoriais, chemoterapija ar radioterapija.
Žvilgsnis į ateitį
AbLec strategija iliustruoja platesnį vėžio imunologijos tendencijų srautą: taikyti ne vien tik imuninės ląstelės „checkpointus“, bet ir mikroaplinkos biocheminius signalus, kurie lemia, ar navikas lieka „nematomas“ immuninei sistemai. Paversdami molekulinius „spąstus“ į tikslingas terapijas, mokslininkai siekia naujais būdais nušviesti naviką imuninei sistemai ir atkurti ar patobulinti priešnavikines reakcijas. Kiti žingsniai apims ankstyvuosius klinikinius tyrimus, kuriuose bus vertinami veiksmingumas, saugumas, optimizuoti deriniai ir realaus pasaulio poveikis. Jei klinikiniai rezultatai bus palankūs, AbLec tipo technologijos gali tapti reikšmingu papildomu įrankiu vėžio imunoterapijos arsenale, praturtinančiu personalizuoto medicinos požiūrio galimybes ir leidžiančiu gydytojams labiau individualizuoti gydymą pagal naviko biologiją ir glikanų profilį.
Šaltinis: scitechdaily


Palikite komentarą