7 Minutės
Išbandykite vaizduotę: imuninė sistema, kuri savo kraują supranta kaip priešą. Keista, taip. Retai pasitaikanti, taip pat. Tačiau dabar tai galima išmatuoti. Tarptautinė mokslininkų grupė nustatė paslapties priežastį, susijusią su kai kuriomis adenovirusinėmis COVID-19 vakcinomis: molekulinį klaidos žingsnį, kuriame iš pažiūros apsauginiai antikūnai virsta žalingais agentais.
Iš klinikinės paslapties prie molekulinio atsakymo
Kelias mėnesių klinikai ir mokslininkai buvo apimti neaiškumo, kai keli pacientai, gavę tam tikras COVID-19 vakcinas, išsivystė neįprasta sindromo forma, kuriai būdingi sumažėjęs trombocitų kiekis ir pavojingi kraujo krešuliai. Šis sindromas — dabar žinomas kaip vakcina indukuota imuninė trombocitopenija ir trombozė (VITT) — buvo retas, tačiau jo sunkumas reikalavo aiškumo. Tyrimų komandos iš McMaster universiteto (Kanada), Flinders universiteto (Australija) ir Greifswald universiteto medicinos centro (Vokietija) suvienijo pajėgas ir sekė pėdsaką nuo pacientų kraujo mėginių iki atskirų aminorūgščių.
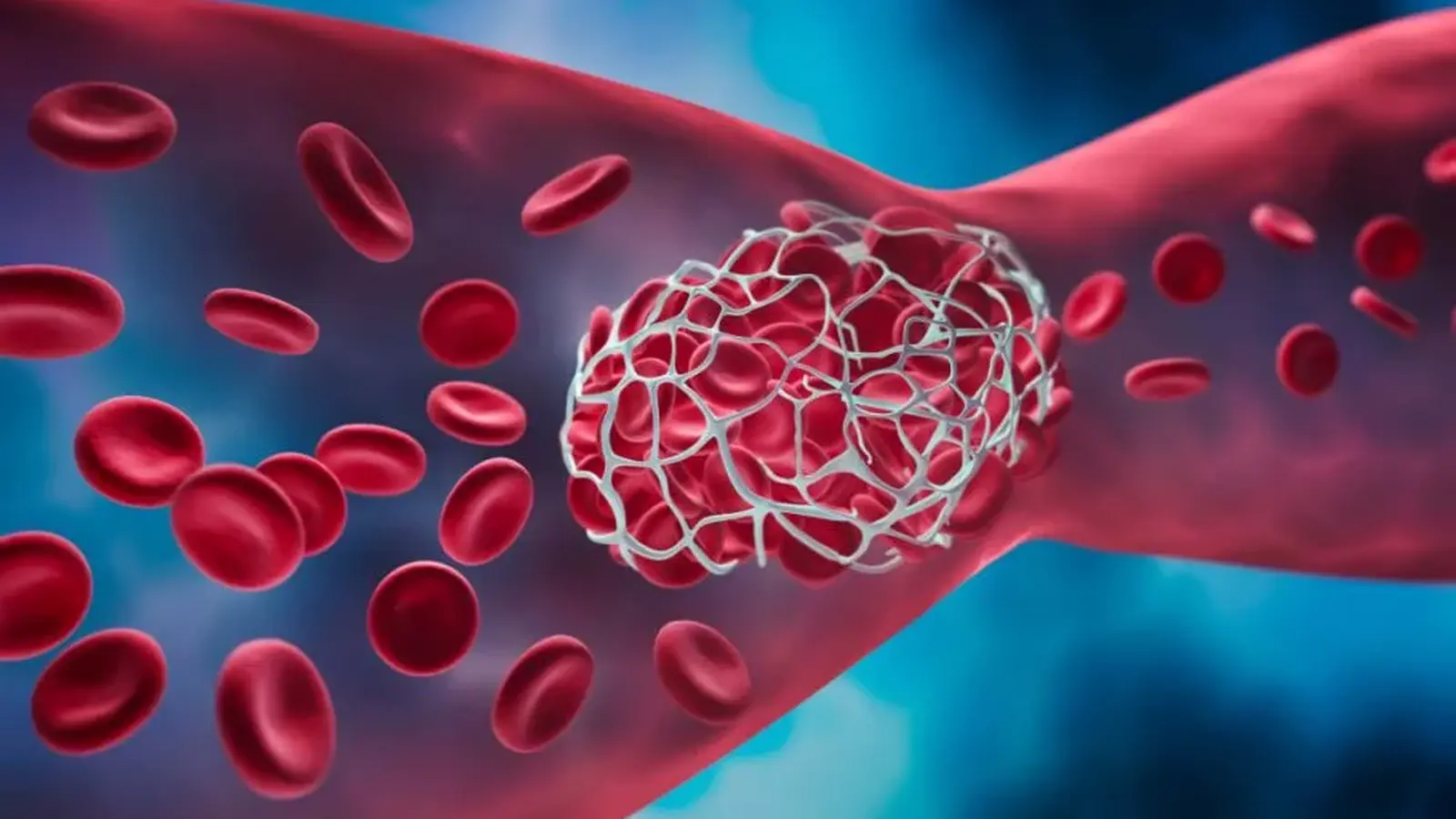
Atranka yra žavi savo paprastumu ir nerimą keliančiomis pasekmėmis. Tais retiems atvejais imuninė sistema gamina antikūnus, kurie nebesutelkti dėmesio vien tik į virusui būdingą taikinį; vietoj to jie kryžmai reaguoja su paties žmogaus trombocitų baltymais ir sukelia krešulių formavimąsi. Tai nėra bendras imuninės sistemos perdėtas atsakas, o tikslus nukrypimas, kurį sukelia specifinė mutacija pačiame antikūne ir tam tikras virusinis baltymas, nuvedantys atsaką nuo normos.
„Molekuliniu lygiu dabar galime pamatyti, kaip normalus imuninės sistemos atsakas į adenovirusą gali, itin retomis aplinkybėmis, būti nukreiptas neteisingai,“ teigia Theodore Warkentin, straipsnio atstovaujantis autorius ir patologijos bei molekulinės medicinos profesorius McMaster universitete. „Nustatydami susijusį virusinį baltymą ir vieną aminorūgšties pasikeitimą antikūne, kuris lemia klaidinančią reakciją, mes ne tik žinome, kas vyksta VITT atvejais, bet ir kodėl tai vyksta.“
Šiame etape svarbu pabrėžti mechanistinius niuansus: kai kurie adenovirusinės vektorinės vakcinos komponentai gali pristatyti specifinį viralinį epitope, kuris imunitetui atrodo panašus į žmogaus trombocitų paviršinius baltymus. Jeigu antikūnas įgyja tam tikrą somatinę mutaciją ir jo atpažinimo vieta pasikeičia, jis gali pradėti dvigubą tikslą — jungtis tiek prie virusinio baltymo, tiek prie trombocitų. Toks kryžminis atpažinimas aktyvuoja trombocitus ir pradeda kaskadą, vedančią prie trombozės ir trombocitopenijos.
Genetika, vienintelė mutacija ir trūkstamas paaiškinimas
Tyrėjų komanda atskleidė du esminius genetinius aspektus. Pirma, beveik 60 procentų žmonių pasaulyje turi tam tikrą paveldimą antikūnų geno variantą — IGLV3-21*02 arba *03 — taigi vien tik to geno buvimas negali paaiškinti, kodėl VITT pasireiškia ypač retai. Antra, kiekvienas ištirtas VITT pacientas turėjo tą pačią somatinę substituciją antikūnų kintamajame regione: K31E pokytį, kai teigiamai įkrauta aminorūgštis pakeičiama neigiamai įkrauta.
Toks pakeitimas iš pirmo žvilgsnio atrodo menkas. Iš tiesų taip. Tačiau molekulinio atpažinimo mastelyje vienas krūvis gali pakeisti, prie ko antikūnas prisijungia. Kai mokslininkai laboratorijoje inžineravo antikūnus ir grąžino K31E pakeitimą atgal į pradines sąlygas, antikūnai prarado gebėjimą inicijuoti krešulių formavimąsi. Tas eksperimentas suteikia stiprų priežastinį įrodymą: K31E yra būtinas patogeninės veiklos mechanizmui, matomam VITT.
Ką tai reiškia fiziologiniu požiūriu? Siūloma seka prasideda nuo antigeninės ekspozicijos — vakcinacijos adenoviruso vektoriumi arba natūralios infekcijos — kuri sukelia antikūnų gamybą prieš tam tikrą virusinį baltymą. Labai nedidelėje imuninės ląstelių dalyje antikūnų geno atkarpa ne tik naudoja IGLV3-21 alelą, bet ir įgauna somatinę K31E substituciją. Pakitęs antikūnas įgauna gebėjimą prisijungti prie virusinio baltymo ir tuo pačiu metu prie trombocitų baltymo, inicijuodamas trombocitų aktyvaciją, jų agregaciją ir galiausiai intravaskulinę trombozę.
Tyrimas, paskelbtas New England Journal of Medicine, užpildo spragą tarp klinikinio pastebėjimo ir molekulinio mechanizmo. Jis paaiškina, kodėl tas pats virusinio vektoriaus pagrindas gali būti saugus milijonams žmonių, tačiau itin retai sukelti sunkių pasekmių pavieniams asmenims: tam, kad VITT įvyktų, turi sutapti tiek genetinis fonas, tiek specifinė somatinė mutacija.
Be intelektualinio smalsumo patenkinimo, šis darbas turi praktinę reikšmę. Tiksliai žinodami, koks virusinis komponentas ir koks antikūnų pokytis prisideda prie patogenezės, galime plėtoti tikslesnę diagnostiką, patobulintus vakcinų dizainus, išvengiančius probleminio epitopo, ir taikytines terapijas, kurios neutralizuotų žalingus antikūnus ne slopindamos visos imuninės sistemos. Tai perbrandina VITT — ne kaip nepaaiškinamą imuninio atsako gedimą, o kaip suvokiamą ir iš dalies užkertamą molekulinį įvykį.
Reikšmė diagnostikai yra aiški: specifiniai laboratoriniai testai, orientuoti į K31E turinčius antikūnus arba į jų kryžminio atpažinimo profilį, galėtų identifikuoti pavojų ankstyvoje stadijoje. Toks požiūris reikalautų detalių antikūnų sekos analizės ir panaudotų technologijų, pavyzdžiui, masinės spektrometrijos arba aukštos raiškos antikūnų sekoskaitos, kurios gali aptikti ne tik geno alelę, bet ir somatinius pasikeitimus. Tokios diagnostikos pritaikymas klinikoje galėtų padėti atskirti nekenksmingas vakcinacijos reakcijas nuo tų, kurios iš tikrųjų rizikuoja sukelti trombozinius įvykius.
Be to, šie rezultatai turi įtakos vakcinų kūrimui. Vakcinų dizaineriai gali peržiūrėti adenoviruso vektoriaus arba į jį įterptų baltymų sekas ir identifikuoti epitopus, kurie turi potencialą kryžmai atpažinti žmogaus baltymus. Eliminavus arba pakeitus šiuos epitopus, būtų galima išlaikyti vakcinos efektyvumą prieš SARS-CoV-2 ar kitus tikslus, tuo pačiu sumažinant galimybę išprovokuoti toksišką imuninį atsaką, vedantį į VITT. Tai reiškia tikslingus, epitope pagrįstus pakeitimus, o ne visišką technologijos atsisakymą.
Terapinis taikymas taip pat gali būti labiau tikslinis. Vietoj plataus imuninės sistemos slopinimo galima kurti monokloninius antikūnus arba peptidines molekules, kurios selektyviai neutralizuoja patogeninius K31E turinčius antikūnus arba blokuoja jų sąveiką su trombocitų receptoriais. Alternatyvios strategijos galėtų įtraukti plazmos apmokymą (plasmapheresis) arba antigenų decoy dizainą, kur specialiai suprojektuoti antigenai sugautų žalingus antikūnus, kol jie nepasiekia trombocitų.
Vis dėlto svarbu pažymėti, kad mokslas retai yra idealiai švarus. Tyrimas, nors ir labai įtikinamas, turi apribojimų. Pavyzdžiui, kuo tiksliau galima nustatyti, kiek dažnai IGLV3-21 alelė kartu su K31E pasikeitimu išryškėja po skirtingų adenovirusinių vakcinų ar po natūralios infekcijos? Ar yra papildomų genetinių ar aplinkos veiksnių, kurie palengvina šią somatinę mutaciją? Ateities tyrimai turi tirti didesnes populiacijas, skirtingus demografinius grupes ir variacijas tarp vakcinų platformų, įskaitant adenoviruso tipą ir ekspresuotų antigenų sekas.
Be to, epidemiologiniai stebėjimai yra būtini, kad būtų tiksliau įvertinta VITT rizika įvairiuose demografiniuose sluoksniuose ir su skirtingomis vakcinomis. Tai padėtų viešosios sveikatos institucijoms priimti pagrįstus sprendimus apie vakcinavimo strategijas, rizikos informavimą ir prevencines priemones. Svarbu pabrėžti, jog VITT liko itin retas reiškinys, ir kad vakcinacija apsaugo nuo sunkių COVID-19 komplikacijų daugeliui žmonių.
Galiausiai, šis mokslinis pasiekimas parodo, kaip klinikinė medicina ir molekulinė biologija gali veiksmingai sąveikauti: nuo sergančių žmonių pastebėjimų iki atskiestų antikūnų savybių analizės ir laboratorinių pakeitimų, patvirtinančių priežastinį mechanizmą. Tokios tarpdisciplininės pastangos suteikia ne tik atsakymus, bet ir konkrečius sprendimus — diagnostikos priemones, vakcinų tikslinimo strategijas ir gydymo taktiką — kurie kartu gali sumažinti riziką ir pagerinti visuomenės sveikatą.
Mokslas retai būna tvarkingas. Vis dėlto, kai įnoringa klinikinė mįslė pasiduoda kruopščiai molekulinei detektyvinei veiklai, rezultatas yra daugiau nei paaiškinimas — tai naujas svertas, leidžiantis mažinti riziką ir tobulinti prevenciją bei gydymą.
Šaltinis: smarti

Palikite komentarą