7 Minutės
Nematomi, nanoskalės burbuliukai, kuriuos išskiria ląstelės, tampa pagrindiniais žaidėjais vėžio plitimo organizme mechanizmuose. Atkurdami šiuos smulkius kurjerius laboratorijoje, mokslininkai siekia ne tik žemėlapiu užfiksuoti metastazių kelią, bet ir tiksliau pristatyti vaistus į navikus — taip potencialiai sustabdydami vėžio progresiją.
Kas tai per mažytės pūslelės ir kodėl jos svarbios
Kiekviena ląstelė išskiria ekstraląstelines vezikules — membrana apgaubtus darinukus, dažnai mažesnius nei 100 nanometrų, nešančius lipidus, baltymus ir genetinės informacijos fragmentus. Sveikoje biologijoje jos perduoda signalus tarp ląstelių, palaikydamos audinių homeostazę ir regeneraciją. Tačiau vėžio atveju šios vezikulės gali veikti kaip slaptieji kurjeriai: jos paruošia nutolusius audinius, pertvarko mikroaplinkas ir netgi perprogramuoja sveikas ląsteles, kad jos padėtų naviko augimui. Toks procesų kaskadas laikoma kertiniu metastazių mechanizmo elementu — būtent per jas pirminis navikas gali paveikti tolimas organų vietas, tokias kaip kepenys ar plaučiai.
Suprasti vezikulių cheminę sudėtį, paviršiaus baltymų profilį ir kelio parinktis yra būtina norint atsekti metastazių ryšius. Vis dėlto natūralių ekstraląstelinių vezikulių izoliacija ir charakterizavimas iš kraujo ar audinių yra lėtas, techniškai sudėtingas ir rezultatus veikiantis procesas. Šis siauras taškas paaiškina, kodėl bioinžinerijos ir vėžio biologijos tyrimų grupės vis dažniau kreipiasi į sintetinius analogus: liposomas ir kitokias lipidines nanodaleles, kurios imituoja natūralių vezikulių formą ir funkciją bei leidžia kontroliuoti savybes eksperimentiniuose modeliuose.
Kaip mokslininkai atkuria vėžio kurjerius
École de technologie supérieure (ÉTS) interdisciplininė komanda, kuriai vadovauja inžinieriai, kuria liposomas naudodama mikromikserius — mikrofluidinius įrenginius, kurie greitai sumaišo lipidų, baltymų, vandeninius ir alkoholinius tirpalus, formuodami vienarūšes nanopartikules. Reguliuodami lipidų proporcijas, paviršiaus krūvį ir integruotų baltymų kiekį, laboratorija gamina daleles, panašias į ekstraląstelines vezikules tiek dydžiu, tiek biodinamika.
Šios dirbtinės vezikulės pažymimos fluorescenciniais žymekliais, inkubuojamos su kultivuotomis vėžio ląstelėmis ir filmuojamos realiu laiku. Eksperimentai seka, kaip greitai ir kiek nanopartikulių populiacijos yra perimama ląstelių, bei identifikuoja biochemines savybes, kurios skatina įsiurbimą. Trumpai tariant, kuo artimesni liposomos dydis, paviršiaus krūvis ir baltymų profilis natūralioms vezikulėms, tuo didesnė tikimybė, kad vėžio ląstelė ją absorbuos.
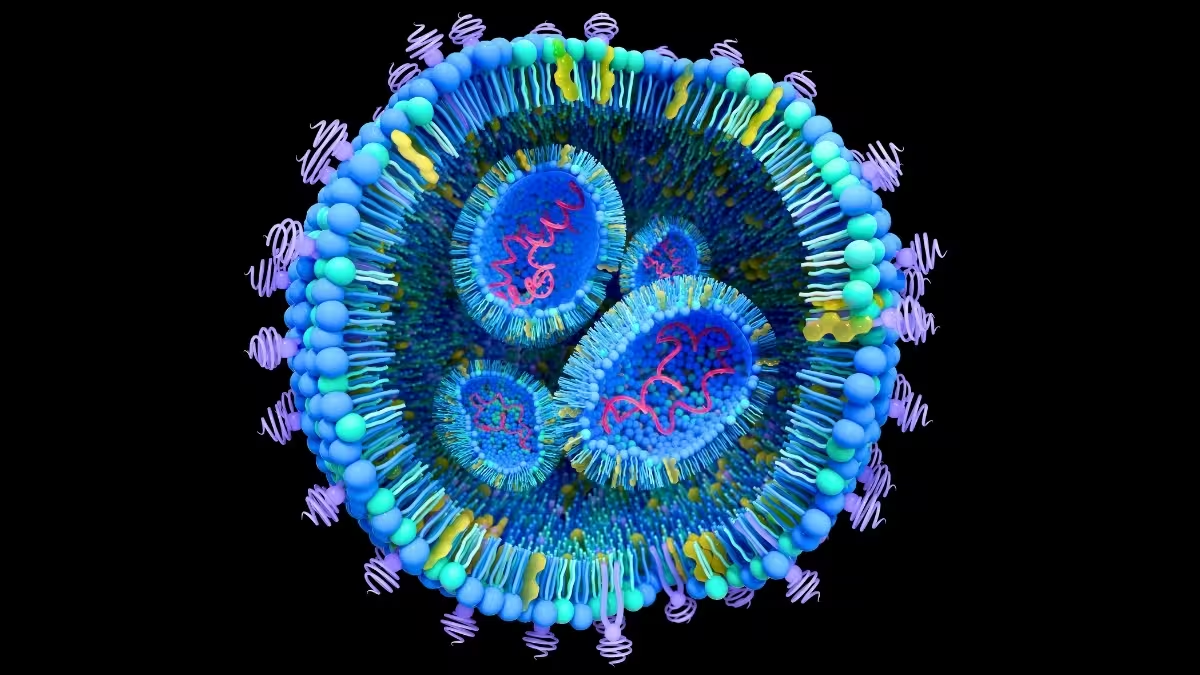
Šis panašumas yra svarbus dviem aspektais. Pirma, tikroviškas mimikas leidžia mokslininkams žemėlapiuoti, kaip vėžio kilmės vezikulės nukeliauja prie konkrečių organų ir kokius signalus jos pristato rezidentinėms ląstelėms. Antra, tai atveria galimybę panaudoti tas pačias nešimo priemones kaip tikslingus vaistų kurjerius — taip patologiją paverčiant pristatymo platforma. Tokios strategijos glaudžiai susijusios su nanomedicinos kryptimis, kurių tikslas yra padidinti vaistų specifiką, sumažinti sisteminį toksiškumą ir pagerinti terapinį indeksą.
Nuo laboratorinių modelių prie terapinių idėjų
Šiuo metu darbas pasiekė apie 50 % efektyvumą baltymų enkapsuliacijai laboratorijoje pagamintose liposomose; komandos tikslas yra artinti šį rodiklį prie 90 %, kad dar tiksliau atkartotų natūralių ekstraląstelinių vezikulių savybes. Kai formulės parametrai bus optimizuoti, protokolas pereis nuo ląstelių kultūrų prie gyvūninių modelių — numatomi žiurkėnų tyrimai, skirti patvirtinti transportą ir terapinio krovinio pristatymą in vivo.
Tyrimų lauke nagrinėjama keletas terapinių strategijų. Viena jų — į liposomas įkelti jau žinomus citotoksinius medikamentus, pavyzdžiui, paklitakselį, kuris lipidinėse nešimo sistemose jau parodė geresnį pristatymą ir toleravimą pacientams. Kita alternatyva — įterpti biologinę aktyvius natūralius junginius; kurkuminas (iš ciberžolės) ir susiję molekuliai daugelyje tyrimų parodė priešuždegiminių ir antiproliferacinių savybių, o kurkumino enkapsuliacija liposomose gerina jo biologinį prieinamumą ir galimybę koncentruotis naviko audinyje.
Be mažųjų molekulių, liposomos gali pernešti ir nukleorūgštis ar antikūnus. Trumpi DNR fragmentai, siRNA arba antikūnų fragmentai gali būti nukreipti į navikus, kad išjungtų onkogenus, padidintų vėžio ląstelių jautrumą vaistams arba pažymėtų piktybines ląsteles imuninei sistemai. Tokios multimodalinės strategijos jau yra nanomedicinos instrumentų rinkinio dalis ir tam tikruose kontekstuose pasiekė klinikinį panaudojimą; jų plėtra ir toliau vyksta mokslinių tyrimų ir reguliavimo sankirtoje.
Ką eksperimentai atskleidžia
Realiojo laiko vaizdavimas rodo, kad dalelių dydis ir paviršiaus chemija yra pagrindiniai įsisavinimo veiksniai. Dalelės, atkuriantys natūralių vezikulių skersmenį ir elektrostatinį profilį, in vitro yra efektyviau internalizuojamos kepenų vėžio ląstelėse. Tai leidžia manyti, kad organų specifiškai nukreiptai metastazei iš dalies gali lemti cirkuliuojančių vezikulių fizinis identitetas — jų dydis, formos parametrai ir paviršiaus molekulės.
Toks supratimas peržiūri ilgai nagrinėtą klausimą metastazių tyrimuose: ar organų taikymą daugiausia lemia naviko išskiriami molekuliniai signalai, ar svarbų vaidmenį atlieka fizinės pristatymo sistemos — pačios vezikulės? Atsakymas, atrodo, yra abiejų mišinys. Biocheminis krovinys siunčia instrukcijas tikslinei audinių aplinkai, tuo tarpu vezikulės fizinės savybės nusprendžia, ar krovinys pasieks tikslą pakankamu kiekiu, kad sukeltų biologinį poveikį. Ši daugiakryptė sąveika — „signalas + transportas“ — suteikia mechanistinį pagrindą tolesniems terapiniams sprendimams, pavyzdžiui, liposomų paviršiaus modifikacijoms ar ligando integracijai, skirtai organų specifiniam nukreipimui.
Galimos klinikinės pasekmės
- Metastazių prevencija: jei pavyktų blokuoti vezikulėmis perduodamą nutolusių organų paruošimą, metastazės galėtų nesusiformuoti. Liposomų pagrindu veikiančios „decoy" sistemos arba inhibitoriai galėtų sulaikyti kenksmingas vezikules prieš joms spėjant suaktyvinti palankią mikroaplinką.
- Tikslingas gydymas: liposomos, sukurtos imituoti navikines vezikules, galėtų selektyviai pristatyti citotoksinius vaistus arba genų terapijas metastatiniams nišoms, taip sumažinant sisteminį toksiškumą ir gerinant terapinį santykį.
- Biomarkeriai ir diagnostika: vezikulių sudėties charakterizavimas kraujyje gali suteikti ankstyvuosius įspėjamuosius signalus apie metastazavimo riziką arba gydymo atsaką, leidžiant pritaikyti asmeninius stebėjimo ir gydymo planus.
Tai ne tolimos svajonės, o išmatuojami tikslai. Keletas nanoformuliacijų jau naudojamos klinikoje, o vykdomi tyrimai nuolat tobulina dalelių dizainą, siekiant padidinti specifiką, sumažinti imunologinį pašalinimą ir optimizuoti krovinio atpalaidavimą. Be to, integracija su diagnostine nanotechnologija (theranostics) gali suteikti realaus laiko grįžtamąjį ryšį apie vaisto patekimą į naviką ir terapinį efektą.
Eksperto įžvalga
"Atkurti organizmo savus komunikacijos paketus suteikia mums tiek mikroskopą, tiek žemėlapį," teigia dr. Elena Marquez, hipotetinė biomedicinos inžinerijos ekspertė, tirianti nanonešiklius. "Kai laboratorijoje pagaminta liposoma elgiasi kaip nuo vėžio kilusi vezikulė, galime stebėti pristatymo kelią ir vėliau kurti intervencijas, kurios arba blokuoja kenksmingus signalus, arba naudoja tą pačią trasą tiksliniam terapiniam pristatymui."
Tokia perspektyva pabrėžia požiūrio dvigubą vertę: gilinti fundamentines žinias apie metastazę ir spartinti translacinius sprendimus, kurie galėtų greičiau pereiti nuo eksperimentų prie klinikinių taikymų. Be to, integruota tarpdisciplininė metodika — derinant molekulinę biologiją, mikrofluidiką ir farmacinę chemiją — didina tyrimų rezultatyvumą ir atsparumą translacinėms kliūtims.
Iššūkiai ir tolesni žingsniai
Vis dar išlieka reikšmingų kliūčių. Reikia mastelio keitimo sprendimų vienarūšėms dalelių gamybai, užtikrinti stabilų baltymų enkapsuliavimą, vengti greito imuninio pašalinimo ir patvirtinti saugumą gyvūniniuose modeliuose. Be to, reguliavimo keliai kompleksiniams biologiniams–nanodalelių hibridams vis dar bręsta, kas gali sulėtinti klinikinę translaciją. Šie klausimai apima tiek gamybos technologijų optimizavimą (GMP atitikimą), tiek išsamias toksikologines ir imunologines studijas, skirtas nustatyti ilgalaikį saugumą ir terapinį naudos/risiko santykį.
Vis dėlto tarpdisciplininių komandų kasdieniai mažieji atradimai susilieja į aiškesnį vaizdą: ekstraląstelinės vezikulės nėra vien ligos epifenomenai — jos veikia kaip aktyvūs vėžio progresijos agentai. Kopijuodami šias struktūras, tyrėjai gali gauti svertą, reikalingą metastazių prevencijai ar gydymui efektyviau įgyvendinti.
Pereiti nuo ląstelių kultūrų prie gyvūninių modelių yra esminis artimiausias ÉTS–McGill bendradarbiavimo etapo tikslas. Jei tie tyrimai pasiseks, jie galėtų atverti kelią žmogaus tyrimams su liposomų pagrindu veikiančiais interceptoriais ir tikslingais pristatymo mechanizmais — technologijomis, galinčiomis pakeisti prognostiką pacientams, kuriems padidėjusi metastazavimo rizika.
Šaltinis: sciencealert

Palikite komentarą