7 Minutės
Tyrėjai nustatė subtilų, su amžiumi susijusį pokytį žarnyno epitelio ląstelėse — DNK žymėjimų persiskirstymą, kuris palaipsniui gali tylinti navikų slopinimo genus ir plėstis per žarnyno paviršių dar prieš atsirandant navikams. Nauji eksperimentai rodo, kad uždegimas, pakeisti ląstelių signalai ir geležies disbalansas gali skatinti šį procesą, kuriuo dalinai paaiškinama, kodėl rizika susirgti storosios žarnos vėžiu didėja su amžiumi.
Kaip senėjimas perrašo genų valdymą žarnyne
Mokslininkai šį reiškinį apibrėžia kaip su amžiumi ir storosios žarnos vėžiu susijusį (ACCA) metilinimo poslinkį: tai DNK metilinimo pakitimų raštas, kuris gali išjungti genus nekeisdamas pačios genetinės sekos. DNK metilinimas yra epigenetinis žymuo — cheminis antspaudas, nurodantis ląstelei, ar konkretus genas turi būti aktyvus. Per dešimtmečius šie žymenys gali pasislinkti, kauptis arba išnykti, taip audiniui formuojant „senesnį“ epigenetinį profilį.
Tyrėjų tarptautinė komanda palygino sveiką storosios žarnos audinį iš skirtingo amžiaus žmonių su kolorektaliniais navikais ir rado persidengiančias metilinimo sritis. Toks panašumas rodo, kad epigenetinis poslinkis, kuris pasirodo normalaus senėjimo metu, taip pat atsispindi vėžinėse audinių dalyse — tai nurodo galimą bendrą kelią nuo amžiaus susijusių molekulinių pokyčių iki padidėjusios vėžio rizikos.
Šis atradimas išplečia supratimą apie storosios žarnos vėžį: ne tik genetinių mutacijų kaupimasis, bet ir epigenetinių žymenų dinaminiai pokyčiai bei jų plėtimasis per audinį gali būti svarbūs ankstyvieji rizikos veiksniai. Tokie epigenetiniai pokyčiai gali keisti genų raišką visose ląstelėse, o ne tik ten, kur atsirado atskiros mutacijos, todėl rizikos zonos gali išlikti ir didėti per ilgą laiką.
Iš kur prasideda poslinkis ir kaip jis plinta
Šis reiškinys prasideda žarnyno kriptose — mažose kišenėse žarnų gleivinėje, kur yra kamieninės ląstelės, atsakingos už epitelio nuolatinę atnaujintį. Naudodami žmogaus mėginius, pelių modelius ir laboratorijoje auginamus organoidus (miniatiūrines žarnyno sistemas), tyrėjai atsekė ACCA poslinkį iki pokyčių kriptų kamieninėse ląstelėse. Kai tokios kriptos dalijasi ir pakeičia greta esančias audinių sritis, zonos su senesniu, į vėžį linkusiu epigenetiniu profiliu pamažu plečiasi.
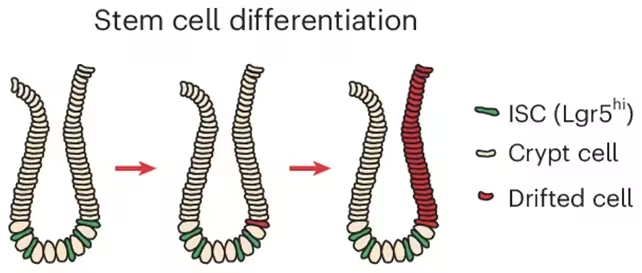
Tyrėjai nustatė, kaip kriptų kamieninės ląstelės keičiasi ir plinta.
Įprasta metilinimo žymenų priežiūra yra dynamiči procesai, kuriuos palaiko įvairios ląstelinės sistemos. Keli veiksniai susilieja ir trikdo šį mechanizmą: žarnyno lėtinės uždegiminės reakcijos, nusilpusi augimo faktorių signalizacija (įskaitant pagrindinius kelių kelius, pvz., Wnt/β‑catenin ir EGFR), bei sumažėjęs ląstelinis geležies kiekis. Kai geležies priklausomi remontiniai fermentai silpsta, neteisingi metilinimo žymenys išlieka ir laikui bėgant genai, kurie įprastai slopina navikų vystymąsi, gali būti išjungti.
Kokie metodai leido tai nustatyti
Tyrimo metodologija apėmė kelis kruopščius žingsnius, leidžiančius susieti epigenetinius pokyčius su fiziniu epitelio plėtimu. Pirmiausia buvo analizuojami žmogaus biopsijų mėginiai iš individų skirtingo amžiaus ir iš skirtingų audinio sričių, kad būtų identifikuoti metilinimo modeliai. Toliau, pelių modeliai suteikė galimybę stebėti, kaip kriptos dalijasi ir kaip epigenetinis profilis perduodamas palikuonėms gyvame organizme. Galiausiai organoidai — tridimensiniai, iš kamieninių ląstelių išauginti mini‑žarnyno modeliai — leido manipuliuoti konkrečiomis sąlygomis (pvz., sumažinti geležies tiekimą arba pakeisti augimo signalus) ir stebėti, ar ir kaip pokyčiai yra atvirkštiniai.
Tokios keliaplanės priemonės suteikia tvirtesnį priežastinių ryšių vertinimą nei vien tik molekulinės koreliacijos: jos leidžia tyrėjams tiesiogiai paveikti potencialius mechanizmus ir stebėti epigenetinių žymių elgseną laike.
Kodėl uždegimas ir geležis yra svarbūs
- Uždegimas išskiria signalus, kurie verčia kamienines ląsteles patirti stresą ir trikdo epigenetinę pusiausvyrą bei žymenų priežiūrą.
- Silpnesnė augimo signalizacija mažina ląstelės gebėjimą taisyti arba pakeisti netaisyklingus epigenetinius raštus, o tai skatina senėjimo profilio išlikimą.
- Neužtenka ląstelinio geležies kiekio — tai pakenkia fermentams, tokiems kaip TET deoksimetilinimo fermentai, kurie priklauso nuo Fe(II) ir dalinai reguliuoja metilinimo žymenis. Kai šių fermentų aktyvumas sumažėja, aberrantinės metilinimo žymos kaupiasi ir gali stabilizuoti navikams palankų genų išjungimą.
Šių mechanizmų sinergija sukuria palankią terpę epigenetiniam „senėjimui“, kai kitos priežastys, pavyzdžiui, oksidacinis stresas ar mitybos trūkumai, tik dar labiau pagilina pokyčius. Todėl suprasti ne tik vieną, bet ir kelių sistemų tarpusavio sąveiką yra svarbu formuojant prevencines strategijas.
„Matome epigenetinį raštą, kuris tampa vis labiau išreikštas su amžiumi,“ — teigė Francesco Neri iš Turin universiteto, pabrėždamas ryšį tarp palaipsnio metilinimo poslinkio ir vėlesnės polinkio į vėžį. Anna Krepelova, taip pat iš Turino, pridūrė, kad kriptų dalijimasis veikia kaip lėtai augantis gobelenas: „Per natūralų kriptų dalijimosi procesą šios sritys nuolat didėja ir gali plėstis daugelį metų.“
Svarbu pažymėti, kad eksperimentiškai nustatyta — poslinkis nebūtinai yra visiškai negrįžtamas. Organoidų modeliuose geležies įsisavinimo atkūrimas arba specifinių augimo signalų grąžinimas sulėtino, o kai kuriais atvejais ir dalinai atstatė epigenetinį senėjimą kriptų kamieninėse ląstelėse. Toks grįžtamumas rodo, kad molekuliniai procesai, kurie lemia senėjimą ir su juo susijusią vėžio riziką, gali būti modifikuojami, o tai atveria naujas prevencijos ir rizikos mažinimo galimybes.
Prevencijos ir tolimesnių tyrimų reikšmė
Šis tyrimas peržiūri storosios žarnos vėžio rizikos supratimą: tai ne tik genetinių mutacijų sukauptų klaidų rezultatas, bet ir progresuojančios epigenetinės permainos, kurios plinta per žarnyno paviršių. Tokia perspektyva atveria papildomas, potencialiai taikomas strategijas, orientuotas į uždegimo mažinimą, geležies metabolizmo reguliavimą ir ląstelių signalizacijos palaikymą žarnyno kamieninių ląstelių nišoje.
Praktinės implikacijos apima kelias sritis:
- Prevencijos programų plėtra: galimi nauji tinklai, skirti sumažinti lėtinių žarnyno uždegiminių ligų riziką, optimizuoti mitybą ir geležies balansą bei skatinti sveiką gyvenimo būdą, kuris mažina chronišką uždegimą.
- Biomarkeriai ir patikra: epigenetinės „pavojingos zonos“ atradimas — specifinės metilinimo sritys, kurios rodo didesnę vėžio riziką — galėtų papildyti tradicines kolorektalinio vėžio patikras (pvz., kolonoskopiją ir molekulinius testus) ir leisti ankstyvą identifikavimą prieš atsirandant makroskopiniams navikams.
- Tikslinei terapijai: žinodami specifinius epigenetinius taikinius arba fermentus, priklausančius nuo geležies, mokslininkai galėtų kurti vaistus arba maisto papildų strategijas, skirtas stabilizuoti arba atstatyti palankius metilinimo modelius.
Nors epigenetinės pavojingos zonos ir ACCA poslinkio greitis skirsis priklausomai nuo individo (genetika, aplinka, gyvenimo būdas, lėtinės ligos), mechanizmų supratimas suteikia tyrėjams konkrečių molekulinių tikslų, kuriuos galima išbandyti priešklininiuose ir klinikiniuose tyrimuose. Publikacija žurnale Nature Aging pabrėžia naują senėjimo biologijos sluoksnį — tokį, kurį galima lėtinti arba koreguoti siekiant sumažinti gyvenimo laikotarpio riziką susirgti kolorektaliniu vėžiu.
Tolesnių studijų kryptys
Ateities tyrimai turėtų sutelkti dėmesį į kelis prioritetus. Pirma, reikia platesnių populiacijinių studijų, apimančių skirtingas amžiaus grupes, etnines grupes ir mitybos profilius, kad būtų įvertintas ACCA poslinkio paplitimas ir individualus kintamumas. Antra, reikalingi intervenciniai tyrimai, kurie patikrina, ar specifinės priemonės — pavyzdžiui, uždegimą mažinanti terapija, geležies homeostazės korekcija arba Wnt signalizacijos moduliai — gali praktiškai užkirsti kelią arba sulėtinti epigenetinį poslinkį.
Trečia, molekulinės priemonės turi būti išgrynintos: būtina identifikuoti pagrindinius fermentus ir kofaktorius, kurie palaiko ar keičia metilinimo žymes kriptų kamieninėse ląstelėse, ir įvertinti jų potencialą kaip diagnostinių arba terapinių taikinių. Galiausiai, verta plėtoti ir pritaikyti pažangias epigenetines atrankas, kurios žymėtų tikslines sritis neinvaziniuose skysčių ar bioptatų testuose.
Tokiu būdu šis tyrimas ne tik praplečia fundamentinę žinių bazę apie senėjimą ir vėžį, bet ir suteikia konkrečių gairių, kaip integruoti epigenetinę informaciją į klinikinę praktiką — nuo rizikos įvertinimo iki prevencijos ir galimų terapinių intervencijų.
Apibendrinant, ACCA metilinimo poslinkis yra svarbus mechanizmas, kuris sieja su amžiumi susijusius epigenetinius pokyčius su ilgalaike storosios žarnos vėžio rizika. Didesnės ir kryptingos mokslinės pastangos gali perkelti šias žinias nuo laboratorijos prie klinikos ir padėti kurti tikslines prevencines priemones, kurios sumažintų gyvenimo trukmę peržengiančią onkologinę naštą.
Šaltinis: sciencealert

Palikite komentarą