6 Minutės
New neural circuit links sleep to body repair
Kai miegame, organizmas persijungia į atstatymo režimą: išsiskiria augimo hormonas (somatotropinas, GH), kuris atkuria raumenis ir kaulus bei reguliuoja metabolinius procesus. Iki neseniai mokslininkai GH matavo imdami kraujo mėginius per miego laikotarpį, tačiau tikslūs nerviniai takai, kurie inicijuoja ir moduliuoja šį hormono išsiskyrimą, liko neaiškūs. UC Berkeley vadovaujama komanda dabar užfiksavo neurono aktyvumą pelėms per kelis miego–budrumo ciklus ir identifikavo grandinę, kuri skirtingai laiko augimo hormono pulsus REM ir non-REM miegų stadijose.
Scientific background and experimental approach
Tyrėjų grupė naudojo nuolatines neuronines registracijas pelėms kartu su hormonų tyrimais, kad susietų specifines neurono populiacijas su GH impulsais. Stebint hipotalamio neuronus ir kituose budrumą paveikiančiuose mazguose esančią aktyvaciją, mokslininkai atskleidė skirtingus GH reguliavimo modelius greitų akių judesių (REM) ir non-REM miegų metu. Darbas, publikuotas žurnale Cell 2025 metais, remiasi ilgalaikiais įrodymais, kad miego kokybė tiesiogiai veikia endokrininę funkciją ir metabolinę sveikatą.
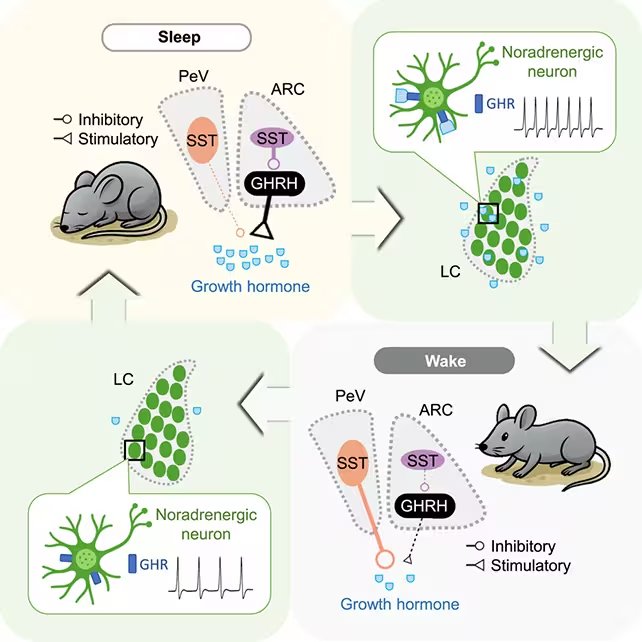
Tyrėjai analizavo augimo hormono išsiskyrimą pelėms per miego/budrumo ciklus.
Key technical points
- Nuolatinės elektrofiziologinės ir optogenetinės registracijos leido tiksliai suderinti neuronų spindesius su GH impulsais.
- Tyrimas atskyrė neuronus, skatinančius GH išsiskyrimą, nuo tų, kurie jį slopina, parodydamas dinamiškus poveikio poslinkius tarp skirtingų miego stadijų.
- Svarbu, kad locus coeruleus — smegenų kamieno branduolys, esminis budrumui — buvo nustatytas kaip grįžtamojo ryšio mazgas su GH reguliuojančiomis grandinėmis.
Main findings and physiological implications
Augimo hormonas padidėdavo tiek REM, tiek non-REM miegų metu, tačiau šio išsiskyrimo skatinėjimo ir slopinimo mechanizmai keitė savo santykinį įtakos laipsnį priklausomai nuo miego stadijos. Atrasta recipročio pobūdžio kilpa su locus coeruleus rodo griežtai subalansuotą sistemą: miegas skatina GH sekreciją, o GH savo ruožtu grįžtamai veikia budrumo mechanizmus. Jei ši pusiausvyra tampa pažeista — dėl chroniško miego trūkumo ar grandinės disfunkcijos — seka reikšmingi metaboliniai padariniai.
GH ne tik būtinas augimui ir audinių atstatymui; jis taip pat reguliuoja gliukozės ir lipidų metabolizmą. Nepakankamas arba netinkamai laiku išsiskiriantis GH, kas gali atsitikti dėl fragmentuoto miego, siejamas su padidėjusia nutukimo, atsparumo insulinui, 2 tipo cukrinio diabeto ir širdies bei kraujagyslių ligų rizika. Naujos grandinės lygmens įžvalgos sujungia pagrindinę miego neurobiologiją su endokrine reguliacija ir ilgalaike sveikata, todėl šis atradimas yra reikšmingas tiek pagrindiniam mokslui, tiek klinikiniam pritaikymui.
Techniniu požiūriu, tyrime panaudotos kelios metodologijos, kurios kartu suteikia didesnį tikslumo laipsnį: implantinės elektrodų masyvai ilgalaikėms elektrinėms registracijoms, optogenetinės kontrolės priemonės norint stimuliuoti arba slopinti konkrėtų neuronų pogrupius, bei dažni kraujo mėginiai GH pulso kinetikai fiksuoti. Tokios sinerginės priemonės leidžia ne tik koreliuoti hormonų lygį su neuroniniu aktyvumu, bet ir patikrinti priežastinius ryšius, pavyzdžiui, laikinai blokuojant locus coeruleus veiklą ir stebint GH pokyčius.
Potential clinical and research applications
Supratimas apie nervinę grandinę, kuri laiko GH išsiskyrimą, atveria naujas terapines galimybes. Tikslinė farmakologija arba neuromoduliacija galėtų atstatyti normalius GH ritmus žmonėms, turintiems miego sutrikimų arba metabolinių ligų. Tyrėjai siūlo, kad locus coeruleus gali būti perspektyvus taikinys: sumažinus jo ekscitojimą galima peradresuoti GH laikymosi mechanizmus ir pagerinti miego tęstinumą. Tokia strategija galėtų būti įgyvendinama naudojant farmakoterapiją, neuromoduliacines procedūras arba perspektyvesnes genetines priemones.
Vertinti ir perduoti pelėms gautus duomenis į žmonių kliniką reikės papildomų tyrimų. Vis dėlto hipotalamo ir smegenų kamieno struktūrų konservatyvus vaidmuo miego bei endokrininės kontrolės srityse suteikia pagrįstą pagrindą tokiam vertimui. Ateities tyrimai galėtų ištirti, ar pakeistas GH–miego grįžtamasis ryšys prisideda prie neurodegeneracinių ligų, tokių kaip Alzheimerio liga, kurioms dažnai būdingas miego sutrikdymas ir metabolinės reguliacijos pažeidimai.
Konkrečiai klinikinei praktikai tai gali reikšti kelis potencialius žingsnius: 1) diagnostinį — įtraukti ilgalaikį hormonų ir miego monitoringą pacientams su miego fragmentacija ar metabolinėmis problemomis, 2) gydymo projektavimą — derinti miego gerinimo intervencijas su terapijomis, kurios atkuria ar palaiko natūralų GH ritmą, 3) prevenciją — ankstyva miego sutrikimų korekcija kaip priemonė mažinti metabolinių ligų riziką.
Expert Insight
"Šie registravimai suteikia mechanistinį vaizdą apie tai, kaip miego stadijų perėjimai kontroliuoja hormoninius pulsus," sako dr. Elena Martinez, miego neurobiologė, nesusijusi su tyrimu. "Jei panašios grandinės egzistuoja žmonėms, atsiveria aiškios galimybės patobulinti gydymo metodus, kurie vienu metu taikytų tiek miego kokybę, tiek metabolinę sveikatą — du tarpusavyje susijusius šiuolaikinių visuomenių iššūkius."
Dr. Martinez taip pat pažymi, kad atsirandančios priemonės, tokios kaip ląstelių tipo specifinė genų moduliacija ir neinvazinė smegenų stimiliacija (pvz., transkranijinė magnetinė stimuliacija arba taikytinė transkranijinė elektrinė stimuliacija), galėtų būti panaudotos testuoti, ar locus coeruleus aktyvumo reguliavimas atkuria normalius augimo hormono ritmus be reikšmingų šalutinių efektų. Ji pabrėžia, kad saugumas ir specifika bus kritiškai svarbūs, ypač kai kalbama apie smegenų kamieno struktūras, kurios reguliuoja gyvybiškai svarbias funkcijas.
Limitations and next steps
Tyrimas suteikia tvirtą pagrindą, tačiau neįrodo, kad grandinės elgsena yra identiška žmonėms. Reikės ilgalaikių žmonių tyrimų, kuriuose būtų derinami polisomnografija, dažni hormonų mėginiai ir vaizdinimo ar neuromoduliacijos metodai, kad būtų galima patvirtinti ir praplėsti pelėms gautas išvadas. Be to, svarbu išsiaiškinti, kaip senėjimas, nutukimas ir neurodegeneraciniai procesai keičia šią miego–GH kilpą ir ar tam tikros patologijos padidina jautrumą grandinės disbalansui.
Tolesni žingsniai moksliniuose darbų planuose galėtų apimti: 1) kryžminius rūšių tyrimus su didesniais imtimis, įskaitant nemiego modelius — pvz., primatus, 2) mechanistinius manipuliavimo eksperimentus, kurie specifiniu būdu moduliuoja hipotalaminę ar locus coeruleus veiklą ir stebi ilgalaikes metabolines pasekmes, 3) klinikinius pilotinius tyrimus, kuriuose derinami miego korekcijos protokolai su specifinėmis neuromoduliacinėmis intervencijomis pacientams su metabolinėmis ligomis.
Taip pat būtina atkreipti dėmesį į potencialias heterogenines reakcijas: genetiniai veiksniai, gyvenimo būdo įpročiai ir lytis gali modifikuoti, kaip GH ritmai reaguoja į miego pokyčius, todėl personalizuoti intervencijų metodai gali būti veiksmingesni už vieno dydžio sprendimus.
Conclusion
Šis tyrimas atkartuoja nervinę grandinę, kuri laiko augimo hormono išsiskyrimą skirtingose miego stadijose ir identifikuoja locus coeruleus kaip grįžtamojo ryšio mazgą, sujungiantį endokrininį signalizavimą su budrumu. Atkreipiant dėmesį į tai, kaip REM ir non-REM miegai skirtingai įtraukia GH skatinančius ir slopinančius elementus, tyrimas sujungia miego fiziologiją ir metabolinę sveikatą. Tęsiant tyrimus, gali atsirasti tikslinės terapijos miego sutrikimams, metabolinėms ligoms ir būklėms, susijusioms su miego bei hormonų disbalansu.
Šaltinis: sciencealert


Palikite komentarą