6 Minutės
Tyrėjai atrado bendrą genetinį ryšį, siejantį aštuonis pagrindinius psichikos sveikatos sutrikimus, atskleidžiant, kaip tam tikri genų variantai veikia per neuronų vystymąsi ir gali daryti įtaką kelioms ligoms vienu metu. Nauji duomenys rodo bendrus molekulinius kelius, kurie galėtų tapti terapijos taikiniais, nukreipiančiais kelis susirgimus vienu metu arba padedančiais suprasti bendras patologines mechanikas.
Bendri genetiniai signalai tarp aštuonių sutrikimų
Psichinės sveikatos genetikos laukas sparčiai plečiasi, ir JAV įsikūrusi tyrėjų grupė pratęsė ankstesnį tarptautinį darbą, žemėlapiu parodydama, kaip tie patys genai prisideda prie skirtingų diagnostinių kategorijų. Dar 2019 m. mokslininkai identifikavo 109 genus, kurie pasirodė įvairiomis kombinacijomis autizme, dėmesio stokos ir hiperaktyvumo sutrikime (ADHD), šizofrenijoje, bipoliniame sutrikime, sunkiame depresijos sutrikime, Turė sindrome (Tourette), obsesinio-kompulsinio sutrikimo (OKS) ir anoreksijoje. Šis sutapimas suteikė biologinį paaiškinimą, kodėl šie sutrikimai dažnai pasitaiko kartu tiek atskiruose asmenyse, tiek šeimose.
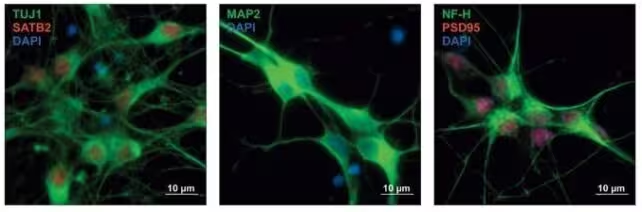
Žmogaus precursorinės neuronų ląstelės, kurios rodomos skirtingomis spalvomis pagal baltymų ekspresiją, nurodant besiformuojančių neuronų tipus.
Naujausias tyrimas, paskelbtas žurnale Cell 2025 m. pradžioje, ėjo toliau nei tik genų sąrašų sudarymas. Vietoj vien tik identifikuotų genų autorių komanda ištyrė beveik 18 000 genetinių variantų, paimtų tiek iš bendro genų rinkinio, tiek iš sutrikimams specifinių genų. Šiuos variantus jie įvedė į žmogaus neuronų precursorines ląsteles, kad stebėtų, kaip variantai veikia genų reguliavimą per smegenų vystymosi kritinius langus. Tokiu būdu buvo galima susieti genetines variacijas ne tik su statistiniais ryšiais, bet ir su funkciniu poveikiu neuronų vystymosi metu.
Metodai, atskleidžiantys kada ir kaip genai veikia
Tyrėjai imitavo variantų aktyvumą besivystančiuose žmogaus neuronuose ir vėliau patvirtino išvadas besivystančiuose pelių neuronuose. Šių eksperimentų metu jie identifikavo 683 variantus, kurie matuojamai keičia reguliacinę veiklą. Techniniu požiūriu tiriamos funkcijos apėmė genų ekspresijos pokyčių stebėjimą per skirtingus vystymosi etapus, reguliacinių skydelių ir promotorių aktyvumo matavimus bei baltymų tarpusavio sąveikų tinklų analizę. Tokie funkciniai testai leidžia susieti genų variantus su biologinėmis pasekmėmis, o ne tik su statistiniais duomenimis iš populiacinių asociacijų.
Daugelis pastebėtų pokyčių buvo pleiotropiniai: vienas variantas darė įtaką kelioms fenotipinėms savybėms arba keliais sutrikimais. Pleiotropiniai variantai ne tik aktyvūs platesniame smegenų ląstelių tipe, bet ir dalyvavo gerokai daugiau baltymų tarpusavio sąveikų nei variantai, susiję tik su vienu sutrikimu. Tai rodo, kad tam tikri genetiniai pokyčiai gali turėti daugiadimensį poveikį, paveikdami kelis molekulinius kelius ir ląstelių tipus vienu metu.
Ką pleiotropija reiškia šiame kontekste
Pleiotropija – genetinė būsena, kai vienas genų pakeitimas veikia kelis biologinius procesus – padeda paaiškinti persidengiančius simptomus ir diagnostinį sutapimą. „Šių genų koduojami baltymai taip pat yra stipriai susiję su kitais baltymais,“ paaiškino Šiaurės Karolinos universiteto genetikas Hyejung Won. „Konkretūs pokyčiai tokiuose centrinėse baltymų grandyse gali sukelti bangas visame tinkle, potencialiai sukeldami plačias smegenų funkcijų perturbacijas.“
Tinklinis požiūris čia yra esminis: daugelis pleiotropinių variantų išlieka aktyvūs per ilgesnius vystymosi laikotarpius ir gali paveikti reguliacinių kaskadų eigą nuo ankstyvos neuronų diferenciacijos iki vėlesnio jų brendimo. Praktiniu požiūriu tai reiškia, kad vienas variantas gali subtiliai keisti kelis vystymosi etapus ir skirtingus ląstelių tipus, todėl klinikiniai rezultatai priklausys nuo laiko (kuriuo vystymosi etapu pasireiškia pokytis) ir konteksto (kokios ląstelės ar molekuliniai keliai tuo metu aktyvūs).
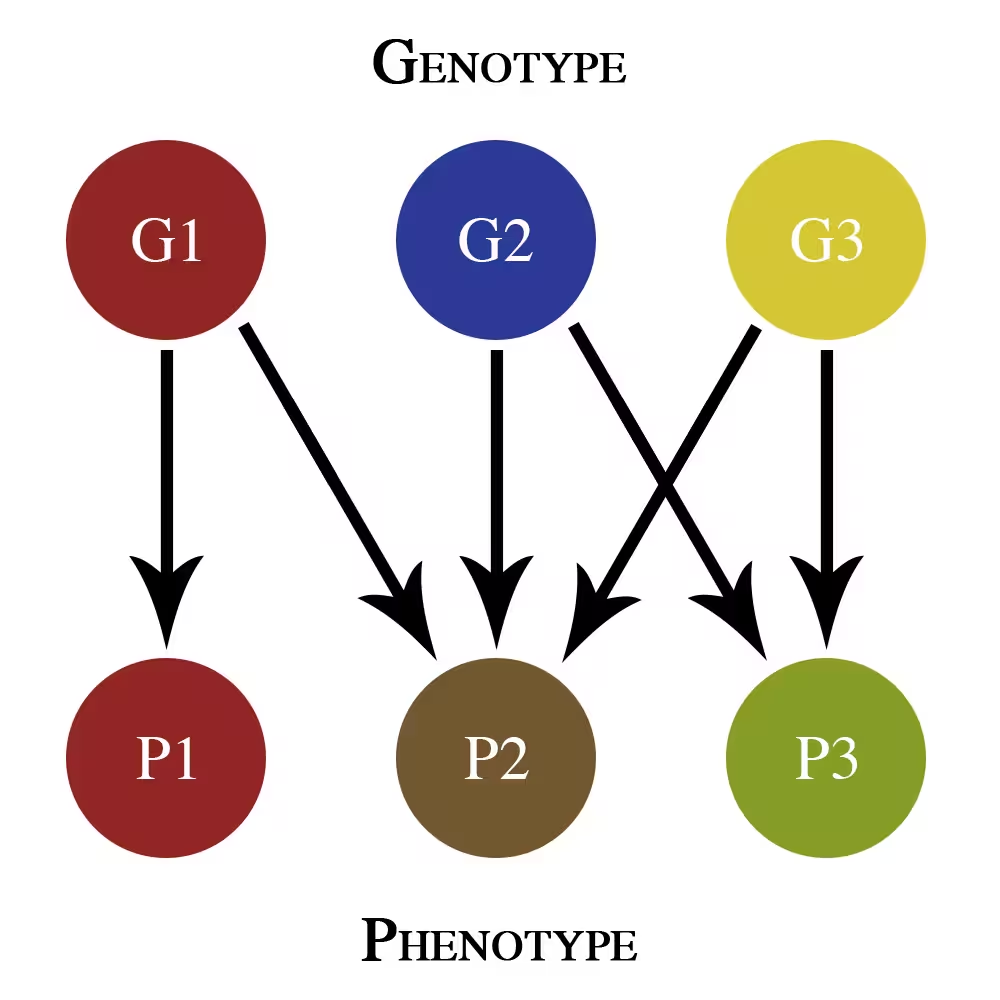
Šis paprastas geno-genotipo ir fenotipo žemėlapis parodo tik addityvius pleiotropijos efektus. G1, G2 ir G3 yra skirtingi genai, prisidedantys prie fenotipinių savybių P1, P2 ir P3.
Kodėl šis atradimas gali pakeisti gydymo strategijas
Gilus supratimas apie bendrą genetinę architektūrą keičia mokslininkų požiūrį į diagnostiką ir terapiją. „Anksčiau pleiotropija tradiciškai buvo vertinama kaip iššūkis, nes ji apsunkina psichikos sutrikimų klasifikaciją,“ sakė Hyejung Won. „Tačiau jei sugebėsime suprasti pleiotropijos genetinį pagrindą, galėsime kurti gydymo priemones, nukreiptas į bendrus genetinius veiksnius, kurios iš esmės gali padėti gydyti kelis psichikos sutrikimus su bendra terapija.“
Tai reiškia, kad vietoje simptomų valdymo pagal atskirą diagnostinę kategoriją, ateities terapijos galėtų susitelkti į centrinės reikšmės taškus baltymų sąveikų tinkluose arba į pagrindinius reguliacinius kaskados mazgus. Tokie taikiniai teoriškai galėtų sumažinti simptomų naštą keliose diagnostinėse grupėse, o tai ypač svarbu visuomenės sveikatai, atsižvelgiant į plačius psichikos sutrikimų paplitimo rodiklius.
Pasaulio sveikatos organizacija (PSO) vertina, kad maždaug vienas iš aštuonių žmonių – beveik milijardas visame pasaulyje – gyvena su tam tikra psichikos sveikatos forma. Tokie skaitymai pabrėžia, kodėl investicijos į pagrindines mechanikas ir bendrų molekulinių kelių tyrimus yra būtinos: jos gali padėti sukurti efektyvesnes prevencines strategijas, tikslines farmakologines priemones ir personalizuotas intervencijas, grindžiamas genetiniu rizikos profiliu ir laikiniu poveikiu vystymuisi.
Be terapijų, tyrimas suteikia aiškų veiksmų planą tolimesniems darbams: prioritetu laikyti pleiotropinius reguliacinius variantus, žemėlapinti jų laikinį aktyvumą besivystančioje smegenų aplinkoje ir tikrinti, ar intervencijos bendruose keliuose mažina riziką kelioms ligoms vienu metu. Toks integruotas požiūris reikalauja tarpdisciplininių komandų – genetikų, neurobiologų, bioinformatikų ir klinikų – dirbančių kartu, kad rastų geriausius taikinius naujiems vaistams, biologinėms terapijoms ar moduliuojančioms intervencijoms.
Techninėms detalėms priskiriant daugiau svorio, svarbu pabrėžti, kad šioje srityje naudojamos priemonės, tokios kaip funkcinių variantų testavimas, informacijos susiejimas su transkripcija ir baltymų tinklų analizė, leidžia pereiti nuo koreliacinių duomenų prie priežastinio supratimo. Tokie žingsniai stiprina mokslinę patikimumą (content authority) ir suteikia praktiškesnį pagrindą naujiems gydymo bandymams bei biomarkerių kūrimui.
Galiausiai, tokio tipo tyrimai konkurencinėje aplinkoje išsiskiria tuo, kad jie orientuojasi į bendras mechanikas vietoje pavienių genų ar pavienių ligų. Tai leidžia atrasti bendras strategijas, kurios gali būti ekonomiškai efektyvesnės ir labiau pritaikomos realaus pasaulio sveikatos sistemoms nei siaurai orientuotos intervencijos.
Šaltinis: sciencealert

Palikite komentarą