8 Minutės
Naujausio tyrimo rezultatai atskleidžia bendrą genetinių variantų tinklą, kuris sieja aštuonias pagrindines psichikos sveikatos sutrikimų grupes. Tai paaiškina, kodėl šios ligos dažnai sutampa viename žmoguje arba kartojasi šeimose, bei atveria kelią plačiau veikiančioms gydymo strategijoms.
Kodėl šis radinys svarbus ir ką reiškia pleiotropija
Psichikos sutrikimų klinikinis perdengimas nėra naujiena: pavyzdžiui, iki 70 % asmenų, turinčių autizmo spektro sutrikimą arba dėmesio trūkumo ir hiperaktyvumo sutrikimą (ADHD), gyvenimo eigoje atitinka ir kitos būklės diagnostinius kriterijus. Tokie koreliaciniai modeliai skatina ieškoti bendrų priežasčių. Viena iš jų — pleiotropija, reiškinys, kai vienas genetinis variantas veikia kelias savybes ar ligas.
Šiame tyrime pleiotropiniai variantai tyrinėti kaip potencialūs tilteliai tarp diagnostinių kategorijų: kaip vienas ir tas pats genas ar jo reguliavimo pokytis gali prisidėti prie skirtingų klinikinių vaizdų priklausomai nuo vystymosi laiko, ląstelės tipo ir molekulinių tinklų konteksto.
Tyrimo aiškinamoji vertė
Tiriant psichikos sveikatą, svarbu suprasti ne tik pavienius rizikos variantus, bet ir jų veikimo mechanizmus — kada ir kur smegenų vystymosi metu jie veikia, kokias reguliacines grandis keičia ir kaip tai atsiliepia neuronų tinklams. Tokia mechanistinė perspektyva leidžia geriau prognozuoti riziką, interpretuoti genų rezultatus klinikinėje praktikoje ir rutulioti terapinius tikslus.
Kaip buvo atliktas tyrimas: dizainas ir metodai
Variantų atranka ir ląstelių modeliai
Tyrėjų komanda sudarė sąrašą beveik 18 000 genetinių variantų, surinktų iš ankstesnių plačių genomikos analizų. Tie variantai atkartojo dvi grupes: vieną — su konkrečiais sutrikimais susijusius variantus, ir kitą — variantus, kurie pasirodė bendri kelioms diagnozėms. Toliau mokslininkai sutelkė dėmesį į tai, kaip šie variantai keičia genų ekspresiją ir reguliaciją žmogaus nervinių protėvių ląstelėse (neural precursor cells), kurios modeliuoja ankstyvąjį neurovystymąsi.
Ląstelių kultūrose variantai buvo įvedami taip, kad būtų galima stebėti jų poveikį genų reguliaciniams tinklams įvairiais vystymosi etapais. Dalis rezultatų buvo patvirtinti eksperimentuose besivystančiose pelės neuronuose, kas padėjo įvertinti konservatyvumą tarp rūšių ir funkcinius efektus gyvūniniame modelyje.
Technologijos ir analizės
- Genominės atrankos: didžiųjų genomikos duomenų integracija siekiant identifikuoti kandidatus.
- CRISPR bei kiti genų redagavimo būdai: leidžia tiksliai keisti genetinį kontekstą ir stebėti reguliacinius pokyčius.
- Vienaląstelinės transkriptomikos ir epigenetinės profiliavimo metodai: atskleidžia, kurie genai aktyvūs tam tikru laiku ir ląstelės tipuose.
- Proteinų sąveikų (PPI) tinklų analizė: nustatė, kaip pleiotropiniai variantai paveikia plataus masto proteomines sąveikas.
Tokiu daugiasluoksniu priėjimu tyrėjai ne tik identifikavo variantus, bet ir įvertino jų biologinį poveikį bei tinklų lygiu atsirandančias pasekmes.
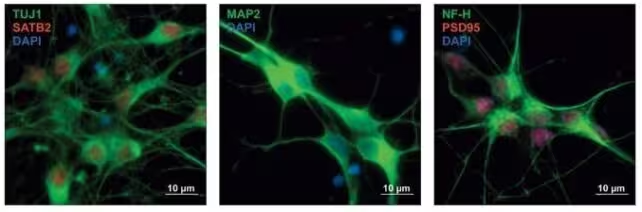
Žmogaus protėvių neuronai, dažyti skirtingais baltymų žymenimis, parodo skirtingas diferencijacijos kryptis. (Won et al., Cell, 2025)
Pagrindiniai atradimai ir ką jie atskleidžia apie smegenų vystymąsi
Tyrimas identifikavo 683 variantus, kurie reikšmingai keičia genų reguliaciją nervų protėvių ląstelėse. Šie variantai pasižymėjo ryškiais bendrumais, palyginti su variantais, susijusiais tik su vienu sutrikimu:
- Didelis tinklų susiejimas: pleiotropiniai variantai daug dažniau paveikia baltymus, kurie turi daug sąveikų su kitais baltymais. Tokiu atveju vieno elemento pokytis gali sukelti grandininę reakciją per platų funkcinių sąveikų tinklą.
- Platesnis ląstelių tipo aktyvumas: šie variantai buvo aktyvūs ne tik viename, bet keliuose smegenų ląstelių tipus — neuronų potipių, gliocitų ar kitų suportinių ląstelių. Tai padidina tikimybę, kad variantas paveiks sekančius neurų tinklų formavimosi etapus.
- Reguliacinės kaskados: pleiotropiniai variantai keičia genų reguliaciją keliais vystymosi etapais, taigi tas pats variantas gali lemti skirtingą klinikinę išraišką priklausomai nuo to, kada ir kuriame ląstelių kamiene jis veikia.
University of North Carolina genetikas Hyejung Won pabrėžė tinklinį požiūrį: — Proteinais, kurių ekspresija keičiama šių genų, sujungtos su daugeliu kitų proteomų dalyvių; jų pokytis gali skleisti signalus per visą tinklą ir sukelti plačius smegenų funkcijos sutrikimus. Tai reiškia, kad pleiotropiniai variantai gali būti tarsi „aukštos įtakos mazgai“, kuriuos nukreipus, galima pasiekti didesnį poveikį rizikai ar gydymui.
Konkrečios biologinės temos: kada ir kur variantai veikia
Vienas iš svarbių atradimų — laiko ir vietos svarba. Pleiotropiniai variantai dažnai aktyvūs ilgesnį laiką arba vėl matomi keliose vystymosi fazėse. Tai reiškia, kad ne tik pats genas, bet ir jo epigenetinis bei transkripcijos reguliavimas gali nuspręsti, ar variantas prisidės prie autizmo, šizofrenijos ar nuotaikos sutrikimų simptomų.
Be to, kintančios ląstelių fenotipų savybės — pavyzdžiui, skirtingi neuronų potipiai, atsakingi už sensoriką, socialinius tinklus ar emocinį reguliavimą — nulemia, kuri klinikinė išraiška bus labiau tikėtina. Kitaip tariant, genetikos pasekmės priklauso nuo „erdvės ir laiko“ smegenų vystymosi kontekste.
Medicininės ir visuomeninės pasekmės: diagnostika, terapija ir prevencija
Supratimas apie bendrus genetinius mechanizmus gali pakeisti tiek diagnostikos, tiek gydymo paradigmas. Tradiciškai medicinos klasifikacijos (DSM, ICD) skirstė ligas pagal simptomus, bet genetinis ir molekulinis perspektyvas siūlo papildomą sluoksnį, kuris galėtų:
- Patikslinti rizikos vertinimą: identifikuoti asmenis su didesne bendrąja genetine rizika, kurie gali būti stebimi intensyviau ar gaunami prevencines intervencijas ankstyvoje stadijoje.
- Pritaikyti terapijas: nukreipti vaistus ar terapines priemones į bendras molekulines kelius, o ne vien tik simptomus priklausomai nuo diagnozės, kas leistų kurti plačiau veikiančias priemones.
- Kuri naujus biologiškai pagrįstus subtipus: klasifikuoti pacientus pagal molekulinius profilius, o ne vien simptomatiką, kas padidintų gydymo efektyvumą ir sumažintų neveiksmingų procedūrų skaičių.
Pavyzdžiui, jei tam tikri pleiotropiniai variantai destabilizuoja baltymų sąveikų tinklus, būtų įmanoma sukurti molekules, kurios stabilizuoja šiuos tinklus arba koreguoja konkretų reguliacijos etapą. Tokiu būdu vienas medikamentas ar biologinė priemonė galėtų sumažinti riziką keliems sutrikimams vienu metu.
Tarptautinės sveikatos organizacijos dabar vertina, kad apie 1 iš 8 žmonių pasaulyje gyvena su psichikos sutrikimu — tai reiškia, jog terapijos, veikiančios bendrus patogenetinius mechanizmus, turėtų didelį visuomenės sveikatos poveikį.
Praktiniai iššūkiai ir etiniai aspektai
Nors idėja taikyti „bendrus kelius“ atrodo patraukli, yra keletas svarbių kliūčių:
- Genetinė heterogeniškumas: net jei pleiotropiniai variantai egzistuoja, jų poveikis asmeniui priklauso nuo daugelio papildomų genų, epigenetikos ir aplinkos veiksnių.
- Laiko langai: kai kuriems poveikiams gali būti reikalinga ankstyva intervencija per kūdikystę ar vaikystę, o tai kelia logistikos ir etikos klausimus dėl genetinių patikrinimų ir gydymo pritaikymo vaikams.
- Neaiškus vertės santykis: investicijos į plačiafunkcines terapijas turi būti kruopščiai įvertintos — ar jos išties duos didesnį klinikinį efektą už specifines terapijas?
- Genetinės informacijos diskriminacija: asmens genetinės informacijos naudojimas gydyme turi būti saugus, griežtai apsaugotas ir etiškai pagrįstas, kad būtų išvengta stigmatizacijos ar neteisingo naudojimo.
Visgi, platus šių variantų veiksmų supratimas leidžia sukurti tikslesnes prevencines strategijas ir eksperimentinius gydymo planus, kurie gali būti testuojami klinikiniuose tyrimuose.
Kas toliau: tyrimų kryptys ir klinikinė vertė
Ateities tyrimų prioritetai gali būti suskirstyti į kelias sritis:
- Funkciniai tyrimai: daugiau modelių, įskaitant organoidus ir žmogaus pagrindu sukurtas neuronų kultūras, skirtas detaliau išsiaiškinti, kaip konkretūs variantai keičia ląstelių takus.
- Klinikiniai biomarkeriai: identifikuoti molekulinius žymenis, kurie rodo, kada pleiotropiniai variantai veikia ir kokius tinklus reikia taikyti gydymui.
- Pilotinės terapijos: bandymai su molekulėmis, mažinančiomis tinklo disbalansą arba koreguojančiomis epigenetinius pokyčius, siekiant įvertinti saugumą ir efektyvumą.
- Duomenų integracija: plėtoti analitinius įrankius, jungiančius genomiką, epigenetiką, vienaląstelinę transkriptomiką ir klinikinius duomenis, kad būtų galima tiksliau priimti sprendimus gydyme.
Šie žingsniai leistų pereiti nuo asociacijų link konkrečių intervencijų ir padidinti tikimybę, kad mokslas duos realų klinikinį naudą žmonėms, susiduriančiams su psichikos sveikatos iššūkiais.
Apibendrinant, šio tyrimo rezultatai ne tik sustiprina genetinio perdengimo tarp autizmo, ADHD, šizofrenijos, bipolinio sutrikimo, didžiosios depresijos, Tureto sindromo, obsesinio-kompulsinio sutrikimo ir anoreksijos nervozės supratimą, bet ir siūlo kryptis tolesniems mechanistiniams ir translaciniams darbams — nuo reguliacijos grandžių analizės iki galimų plataus spektro terapijų testavimo.
Aiškiai identifikavus variantus, kurie stabiliai veikia reguliacinius tinklus per ilgą vystymosi laikotarpį ir įvairiuose ląstelių tipuose, mokslininkai gauna konkrečius molekulinius taikinius tolimesniems funkcinės biologijos tyrimams. Tai žingsnis link gydymo strategijų, kurios galėtų sumažinti ne tik vienos diagnozės simptomus, bet ir bendrą psichikos sutrikimų naštą visuomenėje.
Šaltinis: sciencealert

Palikite komentarą