7 Minutės
Naujas tyrimas rodo, kad kepenys gali būti laikinai paskatintos atkurti jaunesnę imuninę funkciją, išskirdamos signalus, paprastai gaminamus užkrūčio liaukoje (timuse). Pelėse tikslinga mRNR terapija atgaivino T ląstelių gamybą, pagerino atsaką į vakcinas ir navikus, taip atverdama kelią saugesnei imuninės sistemos atjaunėjimo strategijai vyresnio amžiaus žmonėms. Tyrimas jungia idėjas apie imuninę senėjimą, organų specifinę terapiją ir mRNR technologijos panaudojimą, siūlydamas alternatyvą plačiai veikiančioms sisteminėms imunostimuliuojančioms priemonėms.
T ląstelės yra pagrindinė organizmo imuninės sistemos dalis.
Kodėl timusas svarbus — ir kas vyksta su amžiumi
Timusas (užkrūčio liauka) yra nedidelis organas virš širdies, atsakingas už jauniklių limfocitų — T ląstelių — išmokymą atpažinti ir reaguoti į svetimkūnius. Per jaunystę ir ankstyvą suaugimą timusas yra aktyvus, tačiau vėliau pradeda mažėti ir silpnėti procesas, vadinamas timuso invaginacija arba involiucija. Šio proceso metu mažėja naujų T ląstelių gamyba, o imuninės sistemos „klonavimo“ įvairovė — T ląstelių repertoaras — susiaurėja. Dėl to vyresni žmonės tampa labiau pažeidžiami infekcijoms, vėžiui ir dažnai prastesniam atsakui į vakcinas.
Ši fiziologinė pokyčių grandinė yra pagrindinė imunosenescencijos — imuninės sistemos senėjimo — dalis. Mažesnis naujų naïvių T ląstelių pritekėjimas reiškia, kad imuninė sistema turi mažiau „naujų recruitų“, galinčių atpažinti naujus patogenus arba mutavusias vėžio ląsteles. Be to, timusas suteikia specifines molekulines sąlygas, ląstelių sąveikas ir atrankos mechanizmus (pozityvią ir negatyvią atranką), kurie formuoja T ląstelių funkcionalumą ir toleranciją. Kai šios timuso funkcijos silpsta, sutrinka tiek imuninė gynyba, tiek tolerancija, kas gali didinti uždegimų riziką ir autoreaktyvių reakcijų tikimybę.
Tyrėjai iš Broad Institute prie MIT ir Harvard nusprendė ne bandyti atauginti ar tiesiogiai regeneruoti timusą, o pakeisti kai kurias jo skleistinas molekulines žinutes — signalus, kurie nurodo imuninėms progenitorinėms ląstelėms, kaip diferencijuotis ir išlikti gyvybingoms. Jų požiūris buvo panaudoti kepenis kaip alternatyvų biologinį fabriką: kepenys išlieka metaboliniu centru ir baltymų sintezės vieta net ir vyresniame amžiuje, todėl jas galima pritaikyti išskirti specifinius signalus, skatinančius T ląstelių vystymąsi.
Paversdami kepenis į timusą primenančią baltymų gamyklą
Pirmiausia komanda palygino imuninės sistemos komponentus jaunuose ir seniuose pelių modeliuose, siekdami nustatyti pagrindinius signalus, kurių koncentracija mažėja su amžiumi. Analizė apėmė genų raiškos, audinių mikroaplinkos ir citokinų/ligandų profiliavimą, kad būtų identifikuoti tie faktoriai, kurie tiesiogiai veikia T ląstelių likimą ir išgyvenimą. Išsiskyrė trys svarbūs baltymai: DLL1 (Delta-like ligand 1), FLT3-L (FLT3 ligand) ir IL-7 (interleukinas 7). Šie trys veiksniai veikia kaip instrukcijos — jie nurodo progenitorinėms ląstelėms „tapsk T ląstele“ ir „išlik sveika bei funkcinė“ — bei palaiko tinkamą diferencijavimo aplinką.
Konkrečiau: DLL1 yra Notch keliu veikiančios signalizacijos ligandė, esminė T ląstelių linijos nustatymui ir komitavimui; FLT3-L palaiko hematopoetinių progenitorių proliferaciją ir gali skatinti antigenų apdorojimą padedančių linijų plėtrą, o IL-7 yra kritinis citokinas, būtinas naïvių T ląstelių išlikimui, proliferacijai ir homeostazės palaikymui. Kartu šie signalai atkartoja kai kurias timuso niche (mikroaplinkos) funkcijas, reikalingas efektyviai ir įvairiapusiškai T ląstelių gamybai.
mRNA perduoda instrukcijas
Toliau mokslininkai sukonstravo kokybiškai optimizuotas messenger RNR (mRNR) molekules, kurios koduoja šiuos tris baltymus, ir tie mRNR buvo perduoti kepenims senose pelėse per kelias savaites trunkančias injekcijas. mRNR veikia kaip laikinasis baltymų sintezės brėžinys — ląstelės perskaito mRNR ir laikinai gamina nurodytus baltymus, tačiau mRNR neišintegruoja į genomą, todėl pokytis yra grįžtamasis ir laikinas. Tai ta pati technologinė platforma, kurią naudoja kai kurios šiuolaikinės vakcinos, su papildomu dėmesiu organų-tikslingai ekspresijai.
Pristatant mRNR į kepenis dažnai naudojami lipidiniai nano dalelių (LNP) sprendimai arba kiti vektoriai, kurie saugo mRNR nuo degradacijos ir padeda ją nukreipti į hepatocitus arba kitus kepenų ląstelių tipus. Tyrime panaudotas metodo derinys leido kepenims laikinai išskirti DLL1, FLT3-L ir IL-7 į vietinę ir sisteminę aplinką, taip sukuriant palankesnes sąlygas kaulų čiulpų progenitoriams ir migruojančioms ląstelėms diferencijuotis į funkcines T ląsteles be nuolatinės genetinės modifikacijos ar invazinių chirurginių procedūrų.
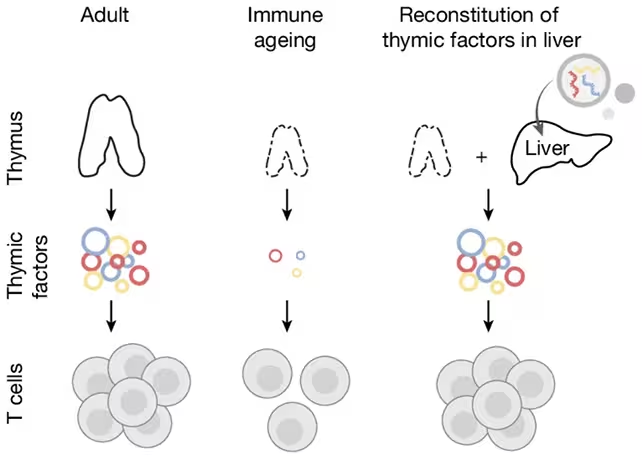
Tyrėjai išnaudojo pelių kepenis T ląstelių gamybos stimuliavimui.
Stipresnės, įvairesnės T ląstelės — bet tik laikinai
Po keturių savaičių gydymo vyresnės pelės parodė reikšmingą pagerėjimą: padidėjusį bendrą T ląstelių skaičių, didesnę T ląstelių įvairovę (TCR repertoaro įvairovę), geresnį antikūnų atsaką į skiepijimą ir stipresnį navikų kontrolės gebėjimą vėžio iššūkio bandymuose. Kitaip tariant, imuninės profilis po gydymo atrodė „jaunesnis“ ir labiau atsparus, su sustiprėjusia geba reaguoti tiek į antigenus, tiek į piktybinius pokyčius.
Rezultatai apėmė kelis santykinai skirtingus imuniteto rodiklius: didesnis naïvių T ląstelių procentas ir daugiau „recent thymic emigrants“ (naujų T ląstelių, neseniai išėjusių iš timuso), geresnė atminties T ląstelių formavimosi kokybė po vakcinacijos, ir didesnis citotoksiškų CD8+ T ląstelių aktyvumas naviko modelyje. Tokie duomenys rodo, kad kepenų gaminami signalai gali ne tik inicijuoti T ląstelių gamybą, bet ir pagerinti jų funkcionalumą bei imuninę koordinaciją.
Svarbu pabrėžti, kad šis poveikis buvo laikinis. Kepenų didesnė signalų sekrecija mažėjo nutraukus gydymą, o imuninės sistemos rodikliai palaipsniui grįžo prie pradinio senėjančio lygio. Autoriai tai traktuoja kaip saugumo privalumą: laikinumas sumažina riziką, kad nuolatinis ir nekontroliuojamas T ląstelių gamybos stimuliavimas sukeltų perteklinį aktyvavimą, kuris gali provokuoti lėtinį uždegimą ar autoimunines reakcijas. Kitaip tariant, organo-tikslinga, laikinai valdomas ekspresijos pulso režimas gali suteikti gerą santykį tarp efektyvumo ir saugumo.
Ką tai reiškia žmonių sveikatai ir kokie tolimesni žingsniai
Pelės modeliuose gauti rezultatai siūlo perspektyvią alternatyvą sisteminėms imuniteto stiprinimo strategijoms, kurios paprastai skystina veikliąsias medžiagas į kraują ir gali sukelti plataus spektro šalutinį poveikį. Kepenys, kaip organas, kuris filtruoja kraują ir yra palyginti prieinamas medikamentų pristatymui, gali tapti praktiška vieta valdomai, organui specifinei imuninės moduliacijos terapijai. Tokia strategija leidžia kontroliuoti ekspresijos trukmę, intensyvumą ir vietą, sumažinant sisteminio citokinų „audros“ riziką.
Vis dėlto pelėse pasiektas sėkmės lygis nereiškia automatinio pritaikomumo žmonėms. Skirtumai tarp žinduolių, timuso biologijos niuansai ir imuninių tinklų sudėtingumas reikalauja atidaus tarpiniavimo. Tyrėjai planuoja išbandyti šį metodą kituose gyvūnų modeliuose (pvz., didesniuose žinduoliuose), patikslinti, kurie signalai ir kokiose dozėse yra optimalūs, bei ištirti poveikį skirtingoms imuninėms ląstelių rūšims. Klinikinė transliacija pareikalaus kruopštaus darbo dėl dozavimo, saugumo, pakartotinio gydymo poveikio ir ilgalaikių pasekmių nagrinėjimo.
Tolimesni žingsniai apims: validaciją daugiau modelių, mRNR vektorių optimizavimą (pvz., LNP formulės, hepatocitų tikslinimas), galimų imuninių reakcijų į mRNR ar vektorių įvertinimą, poveikio autoimunitetui stebėjimą ir patikimus saugumo profilius prieš pradedant žmogaus tyrimus. Taip pat svarbu identifikuoti, ar ilgalaikė periodinė terapija (pvz., kartotinės injekcijos kas keletą mėnesių) gali palaikyti geresnę vakcinų efektyvumą ir mažesnę infekcijų riziką be reikšmingų šalutinių poveikių.
„Siekiame išlaikyti imuninę apsaugą ilgiau gyvenimo eigoje imituodami timuso sekrecijas,“ — sakė Mirco Friedrich (Broad Institute/MIT), apibendrindamas kepenų taikymo strategijos logiką. Feng Zhang (MIT) apibūdino metodą kaip sintetinį, inžinerinį požiūrį į timuso signalų atkūrimą be būtinybės fiziškai atstatinėti užkrūčio liaukos.
Jeigu tokia kepenų mRNR terapija bus patvirtinta žmonėms, ji galėtų tapti įrankiu, mažinančiu amžiaus sukeltą imuninės sistemos silpnėjimą, gerinančiu vakcinų efektyvumą ir ligų atsparumą vyresniems pacientams bei vengiant kai kurių tiesioginių kraujotakos intervencijų rizikų. Tačiau klinikinė kelionė nuo pelių modelių iki saugios ir efektyvios žmogaus terapijos yra ilga ir reikalauja daug tarpdisciplininių pastangų: imuninės biologijos, farmakologijos, mRNR platformų inžinerijos bei reguliavimo klausimų sprendimo.
Apibendrinant, kepenų mRNR strategija reprezentuoja naują kryptį imunosenescencijos problemos sprendime — organų specifinę, valdomą imuninės sistemos moduliaciją. Jei sėkmingai pritaikyta ir saugiai išvystyta, ši technologija gali papildyti esamas prevencines priemones (pvz., vakcinaciją) ir suteikti naują būdą pagerinti sveikatą ir atsparumą ligoms vyresniame amžiuje.
Šaltinis: sciencealert

Palikite komentarą