10 Minutės
Kompaktiškas, nebrangus cheminis junginys parodė įspūdingą poveikį eksperimentiniame Alzheimerio ligos žiurkės modelyje: atstatė atminties deficitus ir sumažino smegenų uždegimą. Atrasta priežastis nukreipia dėmesį į netikėtą kaltininką: perteklinį varį, įstrigusį beta-amiloido plokštelėse. Tyrimą vykdę mokslininkai teigia, kad molekulė pasirodė saugi preklinikinėse bandymuose ir gali pereiti prie žmonių tyrimų — tai atsargiai skatina viltį dėl naujos terapinės prieigos prie Alzheimerio gydymo.
Menininko vizija: amiloidinės plokštelės (oranžinė) kaupiasi ant neuronų (mėlyna)
Why copper matters in Alzheimer's research
Alzheimerio liga dažnai siejama su beta-amiloido baltymų sankaupomis smegenyse. Ar šios plokštelės yra kognityvinio nykimo priežastis, ar tik jo pasekmė — tebėra diskusijų objektas, tačiau jos išlieka nuolatiniu vaistų kūrimo taikiniu. Viena biocheminė kryptis, įgavusi vis didesnį dėmesį pastarąjį dešimtmetį, yra metalų jonų disbalansas — ypač vario (chem. simbolis Cu) dysreguliacija.
Varis yra būtinas mikroelementas, reikalingas normaliam smegenų funkcijavimui; jis dalyvauja energijos gamyboje, oksidacinio streso reguliavime ir neurotransmiterių apykaitoje. Tačiau kai vario homeostazė sutrinka — dėl genetinių pakitimų, baltymų ir fermentų, atsakingų už vario pernašą ir skilimą, arba dėl senėjimo procesų — metalas gali kauptis aplink beta-amiloido depozitus. Tokia perteklinė vario koncentracija gali pagreitinti plokštelių agregaciją ir skatinti oksidacinį stresą, ląstelių žalos formą, susijusią su neuronų nykimu ir kognityvos praradimu.
Svarbu atkreipti dėmesį, kad vario vaidmuo neurodegeneracijoje yra sudėtingas: jis reikalingas gyvybiškai svarbioms cheminėms reakcijoms, tačiau lokalus jo pertekliaus susidarymas molekuliniu lygiu gali turėti toksišką poveikį. Dėl to tyrėjai nagrinėja tiek bendrą organizmo vario apykaitą, tiek specifinius mechanizmus, kuriais varis sąveikauja su beta-amiloidu bei kitais smegenų baltymais. Ši koncepcija susijusi su platesne sąvoka — metalų chelatavimu arba metalų homeostazės modulacija, kuri gali tapti potencialia terapine strategija Alzheimerio ligai ir kitoms neurodegeneracinėms ligoms.
Biomarkeriai, rodantys vario disbalansą, ir vaizdinimo metodai, galintys matyti metalų lokalizaciją smegenų audiniuose, tampa vis svarbesni, nes jie padeda identifikuoti pacientų pogrupius, kurie galėtų geriausiai reaguoti į metalų balansą taisančias terapijas. Tokiu būdu gydymo strategija gali būti tikslesnė, nukreipta į tuos pacientus, kuriems vario disbalansas prisideda prie ligos eigos.
From computer screens to rat mazes: how the team tested compounds
Brazilijos Federalinio ABC universiteto (UFABC) tyrėjai ištestavo devynių kandidatinių molekulių rinkinį, sukurtą pašalinti arba chelatuoti perteklinį varį, susikaupusį ant beta-amiloido. Iš jų aštuoni buvo imidai (organinės molekulės su anglies-azoto dviguba jungtimi), o vienas turėjo kinolino pagrindą. Pradiniuose in silico kompiuteriniuose modeliavimuose buvo atrinkti trys perspektyvūs kandidatai — pažymėti kaip L09, L10 ir L11 — kurie, pagal skaičiavimus, turėjo potencialą pereiti hematoencefalinį barjerą, t. y. būti gebantys patekti į smegenis, kas yra esminė bet kokiam vaistui, veiksiančiam smegenų audiniuose.
In silico modeliai apėmė molekulinės dinamikos simuliacijas, ligandų-baiduose susiejimo tyrimus ir skaičiavimus, vertinant fizikos-chemines savybes, tokias kaip lipofiliškumas ir dalelės dydis, kurie lemia hematoencefalinio barjero praeinamumą. Tokie skaitmeniniai filtrai padeda susiaurinti kandidatų sąrašą prieš pereinant prie brangesnių ir laiko reikalaujančių ląstelių ir gyvūnų bandymų. Tai sumažina išteklių švaistymą ir leidžia labiau koncentruotis į geriau pasižyminčias struktūras.
Toliau sekė ląstelių pagrindu atlikti toksiškumo tyrimai. Kultūrose auginami pelės neuronai buvo 24 valandas eksponuoti trims atrinktiems junginiams. Vienas kandidatas, L11, padidino oksidacinį stresą ir sukėlė ląstelių pažeidimus — tai praktiškai jį diskvalifikavo kaip saugų variantą. Du imidiniai junginiai, L09 ir L10, pasižymėjo mažu toksiškumu ir apsaugojo lipidus bei DNR nuo oksidacinės žalos, todėl jie buvo pažymėti kaip saugesni pasirinkimai pereiti prie gyvūnų bandymų.
Perėjimas prie gyvūnų modelių leido įvertinti ne tik toksiškumą, bet ir biologinį efektyvumą kompleksiškai: ar junginys sumažina perteklinį varį smegenų audiniuose, ar mažina neuroinflamaciją ir oksidacinį stresą, ir ar tai susiję su atminties bei erdvinės orientacijos pagerėjimu. Tokių parametrų tyrimas apima biocheminius rodiklius (vario koncentracijos, oksidacinės žalos žymenys), histologinius tyrimus (ploštelių sankaupos, gliocitų aktyvacija) bei elgsenos testus.
Žiurkės Alzheimerio modeliui sukelti tyrėjai panaudojo streptozotocino injekcijas smegenyse, kurios sutrikdo insulino signalizaciją ir skatina beta-amiloido kaupimąsi bei kognityvinius sutrikimus. Tai yra vienas plačiai pripažintų neurodegeneracijos modelių, leidžiantis tirti vaistų poveikį tiek molekuliniu, tiek elgsenos lygmeniu. Tokie modeliai taip pat padeda nustatyti dozavimo paradigmas, farmakokinetiką ir galimus šalutinius reiškinius prieš pradedant platesnius preklinikinio įvertinimo etapus.
Gyvūnams gydyti taikytos kelios dozavimo schemos ir administravimo keliai (pateikimo peroraliai arba į veną), o po gydymo gyvūnai buvo įvertinti dėl vario lygio hipokampe, uždegimo žymenų ir oksidacinio streso biomarkerių. Elgsenos testuose naudoti erdvinės atminties uždaviniai, pavyzdžiui, labirintai ir V-formos testai, kurie leidžia kiekybiškai įvertinti mokymąsi, atminties išlaikymą ir erdvinę orientaciją.
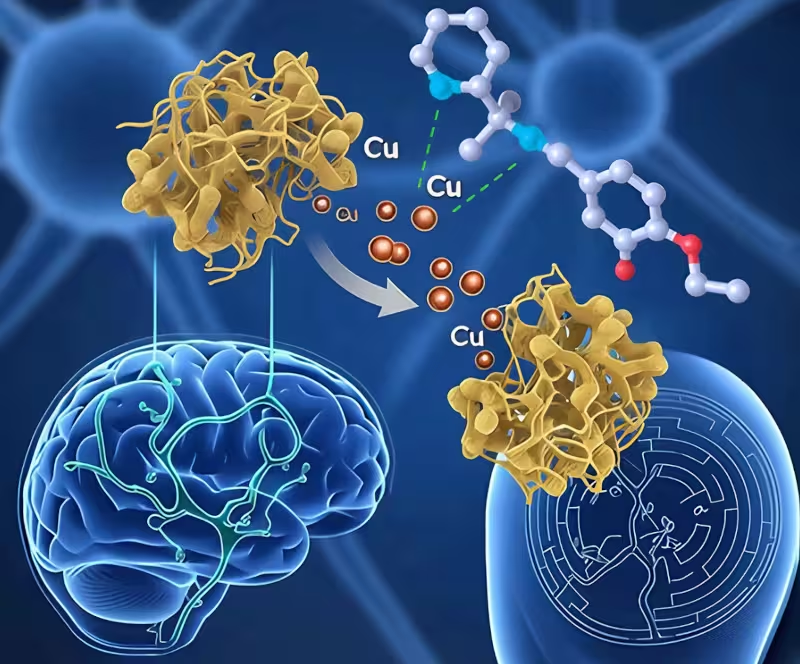
Naujas junginys gali nuimti perteklinį varį nuo beta-amiloido sankaupų
Key discovery: L10 restores copper balance and memory
Iš trijų kandidatų junginys L10 aiškiai išsiskyrė kaip lyderis. Žiurkėms, gydytoms L10, hipokampe buvo normalizuotos vario koncentracijos — tiksliai toje smegenų srityje, kuri yra glaudžiai susijusi su trumpalaike ir ilgalaike atmintimi. Be to, L10 sumažino neuroinflamacijos žymenis ir oksidacinį stresą, o gydytos žiurkės gerokai geriau įveikė labirintus ir kitus erdvinės atminties testus nei negydytos kontrolinės grupės.
Palyginus, L09 rodė silpnesnį poveikį toms pačioms priemonėms, o L11 išlieka toksiškas ląstelių tyrimuose. Remiantis šiais rezultatais, autoriai identifikavo L10 kaip perspektyviausią kandidatą tolesnei plėtrai ir galimai perėjimui prie žmonių tyrimų. Reikšminga tai, kad L10 veikimo mechanizmas, gerokai paaiškintas biochemiškai, sutampa su hipoteze apie vario dalyvavimą plokštelių formavime ir oksidaciniame streso patogeneze.
Tyrimo medžiagoje pateikiami duomenys, rodantys, kad L10 gali chelatuoti varį iš beta-amiloido komplekso, sumažinti metalo katalizuotą reaktiusių deguonies formų (ROS) gamybą ir taip apsaugoti lipidų membranas bei neuronų struktūras nuo peroksidacijos. Tai gali lemti tiek struktūrinį neuronų apsaugojimą, tiek funkcinių tinklų išsaugojimą, kas paaiškina elgsenos pagerėjimą testuose.
Verta paminėti ir praktinius aspektus: pagrindinė tyrimo vadovė Giselle Cerchiaro (UFABC) pabrėžė molekulės cheminį paprastumą ir mažas gamybos sąnaudas, palyginus su daugybe kitų eksperimentinių vaistų. Tokia ekonomiška gamyba gali būti svarbus privalumas, jei junginys pasitvirtins klinikiniuose tyrimuose, ypač atsižvelgiant į tai, kad Alzheimerio liga yra pasaulinė epidemija, kuria serga apie 55 milijonus žmonių pasaulyje.
Be to, mažesnės gamybos sąnaudos gali pagerinti prieinamumą ir platinimą, jei terapija bus patvirtinta. Tačiau reikia atkreipti dėmesį, kad gamybos sąnaudų privalumai turi būti suderinti su ilgaamžiškumo, stabilumo ir dozių saugumo reikalavimais farmacijos gamyboje.
What this means for Alzheimer's treatment strategy
Dauguma šiandien patvirtintų Alzheimerio terapijų siūlo simptominę pagalbą, bet nepanaikina pagrindinės patologijos. Strategija, kuri atkuria metalų balansą smegenyse — mažindama vario sukeltą plokštelių agregaciją ir oksidacinę žalą — atveria kitą terapinį kampą. Tokia terapija neužkerta kelio visiems patologiniams procesams, tačiau ji gali sulėtinti arba moduliuoti kai kuriuos ligos mechanizmus, kurie yra vario priklausomi.
Svarbu, kad tyrimas rodo: tokia prieiga gali būti naudinga ne visiems pacientams, o tam tikram pacientų pogrupiui, kuriam būdingas vario disbalansas arba specifiniai molekuliniai biomarkeriai. Tai pabrėžia Alzheimerio ligos biologinę heterogeniškumą ir poreikį personalizuoti gydymą pagal molekulinius profilus — pavyzdžiui, vario koncentraciją, amiloido ir tau baltymų rodiklius, bei genų variantus, susijusius su metalų apykaita.
Integravus šią strategiją į platesnį gydymo kontekstą, ji galėtų būti arba savarankiška terapija tam tikram pacientų segmentui, arba derinama su kitomis prieigomis, pvz., anti-amiloidinėmis monokloninėmis antikūnų terapijomis, tau-moduliuojančiais vaistais ar neuroprotekcinėmis priemonėmis. Kombinuota terapija, poniūriant skirtingus patologijos aspektus, gali potencialiai pasiūlyti didesnę klinikinę naudą nei vieno mechanizmo sprendimas.
Tokiu būdu ateities klinikiniai tyrimai turėtų atsižvelgti į pacientų atranką ir biomarkeriais pagrįstą stratifikaciją, kad būtų galima nustatyti, kurie pacientai labiausiai pasinaudos vario-chelatuojančiomis terapijomis. Tai apima tiek biochiminius tyrimus, tiek vaizdinimo metodus (pvz., PET arba MR su metalus žyminčiais kontrastais), kurie padėtų identifikuoti vario sankaupas ir amiloido plokštelių sąveikas.
Expert Insight
„Metalų homeostazės taikymasis yra pragmatiška ir mechanistinė strategija,“ sako dr. Anna Morales, neurologė ir translacijaus tyrėjo nesusijusi su tyrimu. „Šis darbas yra skatinantis, nes sujungia aiškią biocheminę hipotezę su etapine preklinikinio vertinimo seka — molekuline modeliuote, ląstelių tyrimais ir gyvūnų elgesio studijomis. Kiti didieji iššūkiai bus saugumas ir efektyvumas žmonėms, taip pat supratimas, ar junginys padeda tinkamiems pacientų pogrupiams.“
Ekspertai pabrėžia, kad tokio tipo tyrimai didina mūsų supratimą apie ligos biologiją ir atveria naujas translacijai tinkamas hipotezes. Dr. Morales papildė, jog tyrimų ekosistemoje svarbu aiškiai dokumentuoti tiek molekulinius mechanizmus, tiek farmakokinetiką, nes tai padeda planuoti klinikinius etapus ir nustatyti potencines rizikas pacientams, pvz., sisteminio vario trūkumo arba širdies-kraujagyslių sistemų poveikį.
Tokie komentarai pabrėžia, kad nors L10 rezultatai yra perspektyvūs, kelias iki saugios ir veiksmingos terapijos patvirtinimo žmogui yra ilgas: reikalingi papildomi tyrimai, siekiant patvirtinti farmakologinį profilį, genotoksikologiją, ilgalaikį poveikį ir optimalų dozių režimą.
Next steps and clinical prospects
Tyrėjai ketina L10 pažengti į žmogaus tyrimus, siekdami nustatyti saugumą, toleravimą ir galimą kognityvinę naudą žmonėms. Prieš tai reikės atlikti išsamesnius toksiškumo tyrimus įvairių rūšių gyvūnuose, GLP (Good Laboratory Practice) atitinkančias tyrimų serijas, farmakokinetikos ir farmakodinamikos studijas, kad būtų patvirtintas tinkamas dozių diapazonas ir pateikti duomenys reglamentiniams vertinimams.
Klinikiniuose tyrimuose kyla klausimai: kaip gerai junginys veiks skirtingose pacientų populiacijose, turinčiose įvairius genų variantus arba komorbidines ligas? Ar L10 galima saugiai derinti su kitomis Alzheimerio terapijomis? Kiek ilgai išsilaikys kognityviniai pagerėjimai ir ar jie bus reikšmingi kasdieniame funkcionavime? Atsakymai į šiuos klausimus reikalauja atsargiai suplanuotų, daugiaetapių klinikinių tyrimų, remiamų biomarkeriais, leidžiančiais stebėti vario disbalansą ir amiloido patologiją gydymo metu.
Be to, reikėtų išspręsti operacinius klausimus: pacientų atranka į klinikinius tyrimus turėtų būti paremta biomarkeriais, o tyrimų dizainas — randomizuotas, dvigubai aklas ir kontroliuojamas placebu. Ilgalaikės stebėsenos etapai padėtų nustatyti, ar atkuriama vario homeostazė išliko, ar reikalingi pakartotiniai gydymo kursai, ir ar yra vėlyvųjų šalutinių poveikių.
Trumpalaikėje perspektyvoje L10 reiškia įdomų, nebrangų kandidatą, nukreiptą į metalų chemiją smegenyse — sritį, kuri gali atverti galimybes taikytoms terapijoms tam tikram Alzheimerio pacientų pogrupiui. Kaip ir visuomet, perspektyvūs gyvūnų duomenys turi būti patvirtinti žmogaus tyrimuose prieš taikant klinikoje, tačiau šis tyrimas pateikia aiškų šabloną, kaip žengti kelią nuo molekulinio suvokimo iki potencialios terapijos.
Galiausiai, jei L10 arba panašūs junginiai pasirodys esantys saugūs ir veiksmingi, tai gali skatinti platesnį mąstymą apie metalų vaidmenį neurodegeneracijose ir prisidėti prie platesnės diagnostikos ir gydymo ekosistemos, kuri apima biomarkeriais pagrįstą pacientų stratifikaciją, personalizuotą mediciną ir potencialiai prieinamesnes gydymo galimybes visuomenei.
Šaltinis: sciencealert

Palikite komentarą