8 Minutės
Įsivaizduokite paradoksinį posūkį vėžio biologijoje: labai seni gyvūnai turi mažiau vėžio, o ne daugiau. Nauji Stanfordo universiteto tyrimai rodo, kad pažengusio amžiaus pelės vysto mažiau ir mažesnių plaučių navikų nei jaunesni gyvūnai, turintys tas pačias onkogeniškas mutacijas. Šie rezultatai verčia pergalvoti paprastą prielaidą, kad vėžio rizika tiesiog nuolat didėja su amžiumi, ir atkreipia dėmesį į amžiaus pokyčius, kurie paradoksaliai gali slopinti navikų formavimąsi.
Tyrėjai teigia, kad išvados paaiškina ilgai stebėtą žmogaus modelį: susirgimų vėžiu dažnis didėja iki vėlyvos suaugystės, bet labai vyresniame amžiuje dažnai stabilizuojasi arba net mažėja. Stanfordo komanda naudojo genetiškai modifikuotas peles ir išsamią molekulinę analizę, kad išsiaiškintų, kurie senėjimo aspektai galėtų riboti vėžio atsiradimą ir kaip specifinės mutacijos elgiasi skirtingais gyvenimo etapais. Šiame tyrime derinami vėžio genetika, senėjimo biologija ir preklininiai modeliai, siekiant geriau suprasti amžinai priklausomus navikų reguliavimo mechanizmus.
A surprising pattern in old mice: fewer, smaller lung tumors
Stanfordo grupė palygino navikų formavimąsi dviejose laboratorinių pelių amžiaus kohortose: „jaunose“ suaugusiose (4–6 mėnesių) ir pelėse, pasiekusiose pažangų amžių (20–21 mėnesių, maždaug žmogaus itin garbaus amžiaus atitikmuo). Kad būtų sukeltas plaučių vėžys, mokslininkai naudojo tikslinį inhaliuojamą genų perdavimo sistemą, kuri generuoja fluorescentiškai pažymėtus navikus ir leidžia tiksliai juos vaizduoti bei matuoti.
Paskatinus vėžio vystymąsi ir laukiant 15 savaičių, kontrastas buvo ryškus. Jaunos pelės sukūrė maždaug tris kartus didesnę navikų naštą, matuotą plaučių mase ir fluorescentine zona, ir turėjo apie tris kartus daugiau atskirų navikų. Jaunų gyvūnų navikai taip pat buvo didesni ir greičiau augantys. Trumpai tariant, visuomet, pagal kiekvieną taikomą matą, jaunesnės pelės rodė agresyvesnę ligos eigą.
Šie rezultatai atspindi epidemiologinius žmogaus duomenis: vėžio sergamumas didėja per vidutinį ir vėlyvą gyvenimą, bet dažnai stabilizuojasi arba krinta po maždaug 85 metų ribos. Iki šiol mokslininkai ginčijosi, ar toks sumažėjimas atsiranda dėl mažesnio tyrimų dažnio ir nepakankamo diagnozavimo labai senyviems žmonėms, ar dėl biologinių veiksnių, mažinančių navikų atsiradimą. Nauji pelių duomenys rodo tikrą, su amžiumi susijusį biologinį efektą, kuris gali slopinti navikų iniciaciją ir augimą.
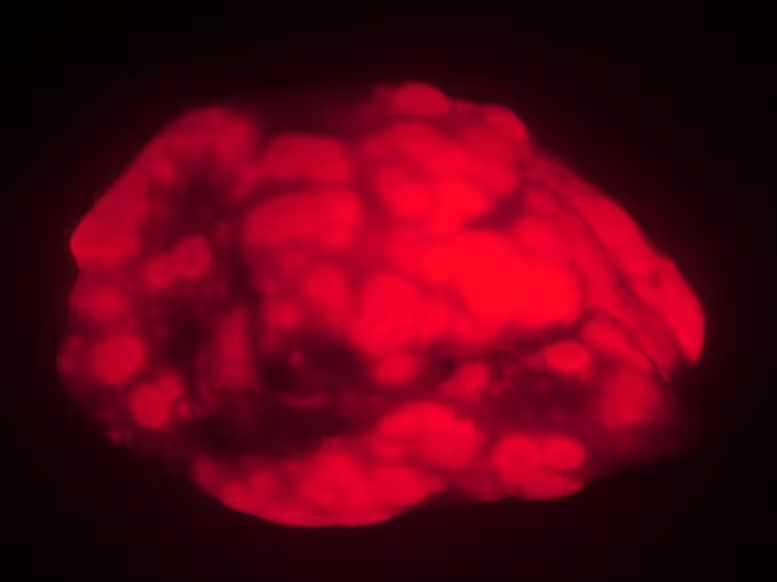
Senos pelės eksperimentiniame modelyje vystėsi mažiau ir mažesni plaučių navikai (raudonos spalvos) nei jaunesnės pelės. Šie duomenys leidžia manyti, kad itin senstant procesai audiniuose gali slopinti vėžio formavimąsi ir progresavimą.
What changes with age could block cancer?
Iš pirmo žvilgsnio senėjimas atrodo palankus vėžio vystymuisi: kiekvienas ląstelių dalijimasis kelia DNR pažeidimo riziką, o daugelis senėjimo požymių — genominis nestabilumas, pakitę DNR metilinimo šablonai ir mitochondrijų DNR pertvarkymai — atrodo kaip palanki terpė piktybiniam transformavimuisi. Daugeliui suaugusiųjų šių žalingų pakeitimų akumuliacija iš tiesų koreliuoja su didėjančiu vėžio dažniu.
Visgi Stanfordo komanda teigia, kad kai kurie su amžiumi susiję pokyčiai gali tapti priešingi neoplazijai. Tyrimas nagrinėjo, kaip 25 žinomų navikų slopintojų genų inaktyvavimas paveikė navikų formavimąsi jaunose ir senose pelėse. Navikų slopintojai (tumor suppressor genes) yra genai, kurių baltyminiai produktai paprastai riboja nekontroliuojamą ląstelių augimą; praradus ar inaktyvavus šiuos genus, vėžys atsiranda lengviau.
Nors daugelio navikų slopintojų genų išjungimas padidino navikų skaičių abiejose amžiaus grupėse, to efekto mastas beveik visada buvo didesnis jaunuose gyvūnuose. Kitaip tariant, toks pats genetinis smūgis jaunesniame audinyje sukėlė griežtesnę ligos eigą. Vienas genas ypač išsiskyrė: PTEN. PTEN inaktyvacija turėjo žymiai stipresnį navikų skatinamąjį efektą jaunuose gyvūnuose nei seniems, kas rodo, jog pagyvenusio audinio biologinis kontekstas keičia tai, kaip veikia pagrindiniai vėžio signaliniai keliai, pavyzdžiui, PI3K–AKT–mTOR reguliacija.
Kad gilintųsi mechanistikai, tyrėjai išsekvenavo genų ekspresijos profilius vėžio ląstelėse iš senų ir jaunų pelių bei iš navikų su PTEN ir be jo. Netikėtai paaiškėjo, kad net greitai besidalijančios vėžinės ląstelės, izoliuotos iš senų gyvūnų, išlaikė molekulines paraštes, susijusias su senėjimu. Šie senėjimui būdingi transkripcijos modeliai sumažėjo, kai PTEN buvo inaktyvuota, o PTEN trūkumas senų pelių vėžinėse ląstelėse leido joms priminti jauno naviko genų ekspresijos profilį — intriguojantis ženklas, kad tam tikri senėjimo bruožai gali būti „ištrinami", kai sutrinka kritiškai svarbūs signaliniai keliai.
A brief note on technical context
Tyrime taikyta fluorescentinė žymė, kad kiekvienam gyvūnui būtų kvantifikuota navikų našta, naudojant kontroliuojamus genų inaktyvacijos įrankius, kad būtų išbandytas kiekvieno navikų slopintojų poveikis, ir RNR profiliavimą (transkriptomiką), kad būtų ištirta, kaip senėjimo parašai išlieka transformuotose ląstelėse. Eksperimentinė schema reikalavo ilgo laiko tarpo — mokslininkai laukė beveik dvejus metus, kol pelės pasiekė pažangų amžių, kas apibūdina, kodėl senėjimo efektai sudėtingai tiriami eksperimentaliai ir reikalauja didelių išteklių.
Techniniai aspektai taip pat apėmė kruopštų kiekybinį vaizdų analizę, audinių histologiją ir bioinformatinius metodus, skirtus identifikuoti senėjimo susijusias transkripcines programas ir signalinius kelius, kurie galėtų būti atsakingi už navikų slopinimą arba atvirkščiai — už jų jautrumo kitimą pagal amžių.
Why the findings matter for cancer research and treatment
Praktiniai išmokimai yra reikšmingi. Pirma, dažnai naudojami vėžio modeliai — dažnai paremti jaunų suaugusių pelių tyrimais — gali neparodyti kritinės amžiui priklausomos biologijos. Tai gali iškreipti priešklinikinį tiriamąjį darbą ir toksiškumo bei veiksmingumo vertinimą, nes terapijos, kurios veiksmingos jaunų audinių kontekste, gali elgtis kitaip vyresniuose audiniuose, kur molekulinė aplinka yra reikšmingai pakeista.
Antra, tyrimas siūlo, kad senėjimas nėra vienareikšmiškai navikų skatinantis. Kai kurios vyresnio amžiaus mikroaplinkos ar ląstelių intrinziški pokyčiai gali priešintis navikų iniciacijai arba sulėtinti jų progresavimą. Tarp galimų mechanizmų yra ląstelių senescencija ir jos susijusi sekretorinė įtaka (SASP), imuninės sistemos remodeliavimas, metaboliniai poslinkiai, epigenetinės adaptacijos, didėjantis audinių standumas ar sumažėjęs proliferacinis potencialas. Jei suprasime šias apsaugines priemones, tai gali atverti naujas terapines strategijas: ar įmanoma farmakologiškai imituoti tam tikras senėjimo grandis, kad audiniai taptų mažiau palankūs vėžiui?
Trečia, skirtingas PTEN inaktyvacijos poveikis įspėja, kad specifinės vairuojančios mutacijos ir jiems taikomos gydymo priemonės gali skirtis pagal paciento amžių. Tikslioji onkologija dažnai derina vaistus su mutaciniu profiliu, tačiau amžiaus kontekstas gali modifikuoti minėtų mutacijų galios laipsnį ir taip keisti gydymo efektyvumą. Tai reiškia, kad klinikinių tyrimų ir gydymo gairių koncepcija turėtų labiau atsižvelgti į amžių kaip biologinį moduliatorių.
Monte Winslow, genetikos ir patologijos docentas bei vienas pagrindinių straipsnio autorių, nurodo, kad šie rezultatai verčia pergalvoti modelių pasirinkimą vertinant farmakologines intervencijas. Dmitri Petrov, vyresnysis bendraautorius, plačiau interpretuoja atradimą: senėjimas gali turėti nepakankamai įvertintų privalumų, kuriuos mokslininkai galėtų išmokti pritaikyti terapijoje arba prevencijoje.
Expert Insight
Dr. Lena Morales, hipotetinė geroscience tyrėja (University Center for Aging Biology), komentuoja: "Šie duomenys pabrėžia, kad senėjimas nėra vienas, linijinis nuosmukis. Kai kurie ląsteliniai keliai, kurie keičiasi su amžiumi, gali sukurti mikroaplinką, mažiau palankią navikų iniciacijai. Tai nereiškia, kad senėjimas apsaugo nuo visų sveikatos problemų — vyresni suaugusieji susiduria su daugiau silpnumo ir kitų ligų — bet tai atveria vertingą tyrimų kryptį: kuriuos apsauginius vyresnų audinių bruožus galime izoliuoti ir paversti terapinėmis priemonėmis?"
Jos požiūris akcentuoja svarbų mokslinį iššūkį: atskirti naudingus nuo žalingų su amžiumi susijusių pokyčių ir nustatyti, kuriuos iš jų saugu imituoti farmakologiniu keliu. Tai apima rizikos ir poveikio analizę, nes kai kurios apsauginės funkcijos, pavyzdžiui, ląstelių senescencija, gali kartu turėti žalingų pasekmių, tokių kaip lėtinis uždegimas (inflammaging) ir audinių disfunkcija.
Broader implications and next steps
- Modelių vystymas: laboratorijoms reikėtų įtraukti pagyvenusius gyvūnus į priešklines gaires, kad būtų užfiksuoti amžiui priklausantys pokyčiai navikų biologijoje ir terapijos atsakuose. Tokia įvairovė padės pagerinti translaciją į vyresnio amžiaus pacientus ir gali sumažinti klinikinių nesėkmių riziką.
- Mechanistiniai tyrimai: reikia identifikuoti, kurie senėjimo parašai — epigenetiniai žymenys, metaboliniai pokyčiai, imuninės sistemos remodeliavimas, senescencijos sekretorinė veikla ar proteostazės sutrikimai — yra pagrindiniai navikų slopinimui vyresnuose audiniuose. Gilinant šias žinias, galima bus tiksliau identifikuoti terapinius taikinius.
- Klinikinė translacija: jeigu bus patvirtinta, kad apsauginiai mechanizmai susiję su senėjimu yra reikšmingi ir saugiai pritaikomi, jie galėtų įkvėpti vaistus, imituojančius šias būsenas jaunesniems pacientams arba sustiprinančius terapiją vyresniems pacientams, atsižvelgiant į fiziologines ir farmacokinetines ypatybes.
- Amžiaus atskirtis klinikiniuose tyrimuose: įtraukimas vyresnių pacientų ir amžiumi subalansuotas stratifikavimas gali padėti geriau suprasti, kaip mutacijos ir gydymai veikia skirtingose amžiaus grupėse ir sumažinti gydymo nepastovumą realiame pasaulyje.
Tyrimas, kuriam vadovavo vyriausioji autorė Emily Shuldiner ir kuri buvo paskelbta lapkričio 4 d. žurnale Nature Aging, yra vienas pirmųjų kontroliuotų demonstracijų, kad senėjimas gali aktyviai slopinti navikų iniciaciją ir augimą mamilinėje modelyje. Jis taip pat parodo, kad su amžiumi susiję molekuliniai parašai gali išlikti dalijančiose vėžinėse ląstelėse, komplikuodami prielaidas apie tai, kaip „jaunos" vėžio ląstelės turėtų atrodyti transkriptominiame lygmenyje.
Apibendrinant, šis darbas perorientuoja požiūrį į senėjimą vėžio tyrimuose: užuot vertinus amžių tik kaip žalingų pokyčių akumuliaciją, mokslininkai turėtų svarstyti senėjimą kaip sudėtingą, sisteminį poslinkį, kuris kartais nustato naujus apribojimus piktybinėms ląstelėms. Sekant šia kryptimi galima atrasti naujas prevencijos ir terapijos strategijas, pritaikytas skirtingų amžiaus grupių biologijai, pavyzdžiui, amžiaus jautrių biomarkerių kūrimą, vaistų, imituojančių apsauginius senėjimo bruožus, bei optimizuotus klinikinių tyrimų protokolus, kurie atsižvelgia į molekulines ir fiziologines skirtis tarp pacientų amžiaus grupių.
Šaltinis: scitechdaily

Palikite komentarą