6 Minutės
Naujas laboratorinis Aarhus universiteto tyrimas nurodo mechanizmą, kuriuo alfa‑sinukleino oligomerai — mažos baltymo, jau susijusio su Parkinsono liga, struktūrų dalelės — gali fiziškai pažeisti ląstelių membranas ir suformuoti laikinas poras. Šie mikroskopiniai plyšiai leidžia nekontroliuojamai pratekti jonams ir mažoms molekulėms, kas gali sutrikdyti ląstelių chemiją ir prisidėti prie nervinių ląstelių disfunkcijos. Rezultatai pateikia detalesnį vaizdą, kaip baltymų agregatai gali pakenkti smegenų ląstelėms ir rodo naujus terapinius taikinius.
Mokslinis kontekstas: alfa‑sinukleinas, oligomerai ir neurodegeneracija
Alfa‑sinukleinas yra normalus neurono baltymas, dalyvaujantis sinapsinių vezikulų transportavime ir neurotransmiterių išsiskyrime. Parkinsono ligos atveju jis gali netinkamai sulipti ir kauptis į didesnius fibrilius, žinomus kaip Levo kūneliai. Kartu su šiais fibriliais dažnai stebimos mažesnės, tirpios struktūros — oligomerai — kuriuos daugelis tyrėjų laiko ypač toksiškais. Naujas tyrimas sutelktas į šiuos oligomerus ir jų fizinę sąveiką su lipidinėmis dvigubomis membranomis, ląstelės membranos pagrindiniu struktūriniu elementu.
Anksčiau jau buvo keliamas hipotezė apie oligomerų sukeltą membranos pažeidimą, tačiau Aarhus komanda panaudojo supaprastintą, gerai kontroliuojamą membranos modelį, kad procesą vizualizuotų beprecedentiniu tikslumu. Izoliuodami šią sąveiką jie sugebėjo užfiksuoti žingsninius pokyčius nuo kontakto iki poros susidarymo.
Eksperimentinė sąranka ir pagrindiniai stebėjimai
Naudodami sintetinį membranų modelį, imituojantį neurono lipidų sudėtį, tyrėjai pristatė alfa‑sinukleino oligomerus ir stebėjo membranos vientisumą aukštos raiškos vaizdavimo bei elektrinių matavimų metu. Komanda apibūdina trijų stadijų procesą: oligomerų pradinis prisitvirtinimas prie membranos paviršiaus, dalinis įsiskverbimas į lipidinę dvigubą membraną ir galutinė restruktūrizacija į per membraną vedantį poros struktūrą.
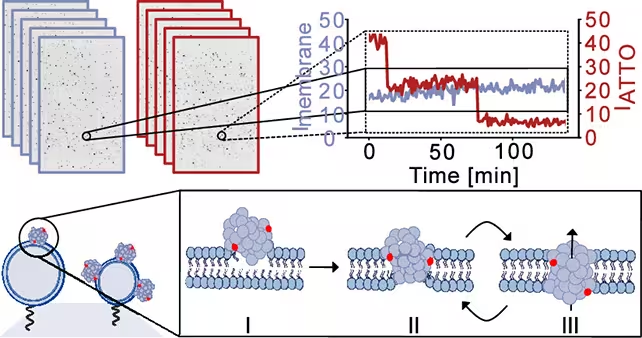
Tyrėjai užfiksavo simuliuotų ląstelių membranų nuotraukas, kad stebėtų, kaip jos buvo pažeidžiamos ir kokį nutekėjimą tai sukėlė. (Bro̷chner et al., ACS Nano, 2025)
Susidariusios poros nebuvo statinės skylės. Vietoje to jos rodė dinamišką elgseną — trumpais intervalais kartais atsidarydamos ir užsidarydamos. Toks pertrūkis svarbus, nes jis gali sukelti epizodinius jonų srautus, kurie palaipsniui trikdo ląstelių homeostazę, o ne sukelia akimirksninį katastrofišką pralaimėjimą.
Membranos kreivumo pirmenybė ir mitochondrijų pažeidžiamumas
Vienas ryškus pastebėjimas buvo oligomerų polinkis prisirišti prie labiau išlinkusių membranų. Didelis membranos kreivumas būdingas viduląsteliniams organoidams, tokiems kaip mitochondrijos. Mitochondrijos yra centrinės neuronų energijos gamybai ir kalcio buferizavimui; jei jų membranos kartotinai yra pradurkinėjamos, tai gali inicijuoti energetinį nepajėgumą, oksidacinį stresą ir tolesnes kelius, susijusias su neurodegeneracija.
Reikšmė Parkinsono ligos mechanizmams ir terapijai
Jeigu alfa‑sinukleino oligomerai gyvuose neuronuose formuotų laikinas poras, tai suteiktų tiesioginį mechanizmą, paaiškinantį, kaip baltymų agregatai gali sukelti funkcijos blogėjimą dar prieš ląstelių žūtį. Laikini joniniai disbalansai, kartojami per laiką, gali sutrikdyti sinaptinį signalizavimą, išbalansuoti kalcio homeostazę ir palaipsniui silpninti neuronų atsparumą. Porų dinamiškas, grįžtamas pobūdis taip pat gali aiškinti, kodėl neuronai dažnai lieka gyvybingi ilgą laiką sergant Parkinsono liga, nors jų funkcija palaipsniui blogėja.
Molekulinės biologės Bo Volf Brøchner, vieno iš bendraautorių, nuomone, porų atsivėrimas ir užsidarymas gali leisti ląstelių pompoms laikinai kompensuoti, atidėliojant greitą kolapsą. Toks kompensacinis laikas gali būti galimybė terapeutiniam poveikiui atstatyti pusiausvyrą arba užblokuoti porų formavimąsi.
Aarhus komanda jau tyrė molekulinius žymenis, vadinamus nanobody — mažas antikūnų fragmentų platformas — kurios gali atpažinti oligomerinį alfa‑sinukleino agregatą po jo susidarymo. Nors šie nanobody yra naudingi aptikimui, jie dar neįrodė gebėjimo užkirsti kelią porų formavimuisi. Būsimos terapinės strategijos galėtų siekti:
- Stabilizuoti alfa‑sinukleino nekenksmingose konformacijose
- Tiesiogiai blokuoti porų formavimąsi naudojant mažas molekules ar antikūnus
- Apsaugoti arba taisyti mitochondrijų membranas
- Pagerinti oligomerų ląstelės pašalinimą per proteostazės ir autofagijos kelius
Apribojimai ir tolesni žingsniai
Eksperimetai buvo atlikti naudojant švarius, sintetinius modelius, kad būtų atskirti vieni kintamieji. Toks eksperimentinis aiškumas yra privalumas — tačiau rezultatai dabar reikalauja patvirtinimo gyvose neuronuose ir gyvūnų modeliuose, kur membranos sudėtis, baltymų partneriai ir ląstelės gynybinės reakcijos yra sudėtingesnės. Tyrėjams reikės patvirtinti, ar oligomerų inicijuotas porų formavimasis vyksta vientisame smegenų audinyje, kaip dažnai tai nutinka ir kurie neuronų potipiai yra labiausiai pažeidžiami.
Tolesni darbai turėtų kiekybiškai įvertinti porų dydį, trukmę ir joninį selektyvumą, taip pat ištirti, kaip jos sąveikauja su ląstelės remonto mechanizmais. Jei tai bus patvirtinta in vivo, tokios poros gali tapti matuojamu ankstyvo neuroninio streso biomarkeriu ir taikiniu ligos modifikavimo terapijoms.
Eksperto įžvalga
Komentaras iš dirbančio neuromokslininko
Dr. Elena Marquez, vyresnioji neurobiologijos lektorė (fikcinė), komentuoja: "Šis tyrimas pateikia įtikinamą mechanistinį ryšį tarp oligomerinio alfa‑sinukleino ir membranos disfunkcijos. Žingsninė prisitvirtinimo, įsiskverbimo ir poros formavimosi vizualizacija padeda suderinti biocheminį toksiškumą su fiziologiniais padariniais — epizodine jonų disreguliacija, o ne akimirksnine nekroze. Iš translacinės perspektyvos iššūkis dabar yra parodyti šiuos įvykius vientisuose neuronuose ir sukurti molekules, kurios užkerta kelią porų surinkimui arba greitai užsandarintų laikinuosius pažeidimus. Lygiagrečiai taikant mitochondrijų membranos apsaugą galėtų būti ypač naudinga, atsižvelgiant į oligomerų polinkį prie kreivumo."
Susijusios technologijos ir ateities perspektyvos
Keletas papildomų technologijų gali paspartinti šių atradimų vertimą į terapiją ar diagnostiką:
- Pažangus gyvų ląstelių vaizdavimas, fiksuojantis trumpalaikius porų įvykius neuronuose
- Biosensoriai jonų srautams ir mitochondrijų membranos potencialui stebėti
- Aukšto pralaidumo ekranai, ieškantys mažų molekulių, blokuojančių porų susidarymą
- Nanobody platformų tobulinimas, neutralizuojant oligomerus prieš jų sąveiką su membrana
Visos šios priemonės gali pasiūlyti ankstyvos stadijos intervencijas, lėtinančias ligos progresą užkertant kelią kartotiniams subletaliniams membranos pažeidimams.
Išvados
Aarhus universiteto tyrimas praplečia mūsų supratimą apie Parkinsono ligą, parodydamas, kad alfa‑sinukleino oligomerai gali modelinėse membranose formuoti dinamiškas poras per prisitvirtinimo–įsiskverbimo–poros formavimo seką. Šie laikini pažeidimai, rodantys polinkį prie kreivų membranų, tokių kaip mitochondrijų paviršiai, gali sukelti epizodinius jonų sutrikimus, kurie kaupiasi ir veda prie neuronų disfunkcijos. Nors reikalingas tolesnis patvirtinimas gyvuose audiniuose, rezultatai išryškina naujus mechanistinius taikinius — nuo oligomerų neutralizavimo iki membranos apsaugos — kurie gali nukreipti būsimą terapinę ir diagnostinę raidą. Tyrimas, publikuotas žurnale ACS Nano, atveria naują kryptį, kaip mažos baltymų struktūros prisideda prie neurodegeneracijos ir kaip šį procesą būtų galima sutrukdyti prieš neišvengiamą funkcijos praradimą.
Šaltinis: sciencealert

Palikite komentarą