8 Minutės
Tyrėjai sukūrė ląstelių inžinerijos metodą, kuris žymiai sumažina reikalingą virusinio vektoriaus kiekį gaminant CAR aprūpintas indukuotas natūralios žudikės ląsteles (iNK). Šis pažangus metodas pažada sumažinti gamybos sąnaudas ir pagerinti mastelio didinimo galimybes CAR pagrįstoms imunoterapijoms, išlaikant stiprų priešnavikinį aktyvumą preklinikiniuose modeliuose. Be to, naujas požiūris į iNK ląstelių indukciją ir genų perdavimą atveria kelią ekonomiškesnei bei saugesnei ląstelių terapijų gamybai, kas yra kritiška norint plėsti prieigą prie klinikinių tyrimų ir galimų komercinių sprendimų.
Kaip nauja technika sumažina virusinių vektorių poreikį
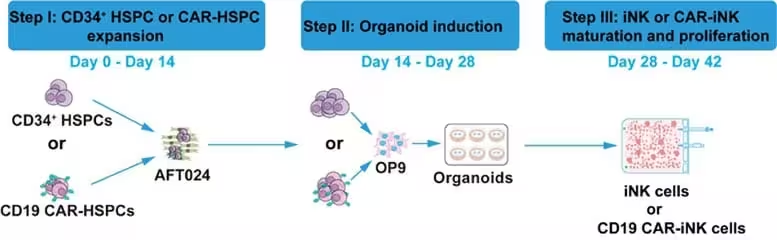
Tradicinė CAR (chimerinė antigeno receptoriaus) inžinerija jau pagamintų NK ląstelių atžvilgiu dažnai reikalauja didelių virusinių vektorių dozių, kad būtų efektyviai perduotas receptorų koduojantis genas ir užtikrintas pastovus ekspresijos lygis. Tuo tarpu aprašytas metodas taikomas ankstyvoje iNK ląstelių indukcijos stadijoje ir leidžia ženkliai sumažinti vektoriaus poreikį. Autoriai praneša, kad pagal jų protokolą vektoriaus įvedimas sumažėjo ekstrapoliuotais dideliais koeficientais: maždaug 1:140 000 šeštą kultūros savaitę ir net iki maždaug 1:600 000 septintą savaitę. Tai reiškia, kad pasiekiant panašią CAR ekspresiją užtenka tik labai nedidelės dalies virusinio vektoriaus, palyginti su įprastiniais standartiniais protokolais.
Techninė prasme šis efektyvumas gali būti pasiektas įvairių veiksnių sąveika: optimizuotos indukcijos sąlygos, subtyrus laiko langų parinkimas genų perdavimui, geresnė transdukcijos efektyvumo kontrolė ir galimas naudojimas papildomų biologinių modifikacijų, skatinančių integraciją ir išlikimą. Be to, mažesnis vektoriaus kiekis sumažina galimas nepageidaujamas šalutines reakcijas, susijusias su vektoriaus persotinimu ir pertekliniu genų perdavimu. Iš praktinės perspektyvos tai reiškia, kad laboratorijos ir gamybos centrai gali efektyviau panaudoti ribotus virusinių vektorių išteklius, sumažinti logistikos komplikacijas ir maksimaliai padidinti vieno vektoriaus partijos panaudojimą.
Svarbu pabrėžti, kad tokio masto vektoriaus taupymas turi įtakos ne tik gamybos kaštams, bet ir biosaugos valdymui. Mažesnis vektoriaus kiekis reiškia mažesnę rekombinantinių vektorių riziką ir supaprastintą atitiktį saugos protokolams bei reguliavimo reikalavimams. Tokiu būdu technologija išplečia praktinį kelią į didesnio masto, klinikinei taikų gamybą, ypač kai kalbama apie „off-the-shelf“ arba paruoštus naudoti NK ląstelių produktus. Be to, sumažinti vektoriaus poreikį gali paskatinti pradinį translacinį darbą ir eksperimentinius dizainus, kuriuose ankstesnės prieigos kliūtys dėl vektoriaus kainos ar prieinamumo buvo ribojančios.
Iš eksperimento metodologinės perspektyvos reikėtų akcentuoti, kad tokio tipo optimizacijos dažnai reikalauja kruopščios kontrolės: tiriami parametrai apima ląstelių šaltinį, indukcijos signalus (citokinus, augimo faktorius), transdukcijos sąlygas (pvz., vektoriaus koncentracija, ekspozicijos laikas) ir tolesnį kultūros palaikymą. Autoriai taip pat galėjo pritaikyti selekcijos mechanizmus arba mRNR/vektoriaus formuluotes, kurios pagerina genų perdavimo efektyvumą pradiniuose diferencijavimo etapuose. Tokie niuansai yra svarbūs, kad optimizacija būtų atkuriama kitose laboratorijose ir kad būtų užtikrintas stabilus CAR ekspresijos profilis iNK ląstelėse.
Funkciniai bandymai: navikų kontrolė leukemijos modeliuose
Bet koks vektoriaus taupymas būtų bevertis, jeigu tai reikštų silpną terapinį efektyvumą. Autorių pranešimuose daugkartiniuose preklinikiniuose tyrimuose ir in vitro ląstelių žudymo testuose tiek neredaguotos iNK ląstelės, tiek CAR modifikuotos iNK (CAR-iNK) ląstelės demonstravo stiprų citotoksiškumą prieš navikines ląsteles. Tai apėmė standartines kitos kartos citotoksiškumo matavimo metrikas, tokias kaip ląstelių gyvybingumas, apoptozės rodikliai ir specifinis navikinių ląstelių skaičiaus mažėjimas ko-kultūrose.
Išsamiau, gyvūnų modeliuose – tiek ląstelių linijų kilmės ksenograftuose (CDX), tiek pacientų kilmės ksenograftuose (PDX) – CD19 taikiniui skirtos CAR-iNK ląstelės pristatė reikšmingą tumorogenezės slopinimą. Konkretūs modeliai apėmė žmogaus B-ląstelių ūminę limfoblastinę leukemiją (B-ALL), kuriai CD19 yra gerai apibrėžtas biologinis tikslas. CAR-iNK terapija sulėtino naviko augimą ir pailgino gyvavimo laiką palyginti su kontroline grupe. Tokie rezultatai yra svarbūs, nes jie rodo, jog sumažintas virusinio vektoriaus naudojimas nebuvo pakeistas kompromisu dėl antitumorinio aktyvumo.
Modeliuose vertinant ilgalaikį poveikį, buvo analizuojami ne tik akutiniai naviko dydžio pokyčiai, bet ir imuninės terapijos išlikimas, infiltruotų ląstelių perėmimas į naviko audinį, išlaikoma CAR ekspresija per laiko tarpą ir galimas ląstelių išnykimas ar anergija. Visos šios metrikos padeda nustatyti realų terapijos potencialą ir jaučių kompromisų buvimą. Be to, palyginimai su tradicinėmis CAR-T ar CAR-NK metodikomis leidžia įvertinti, ar iNK platforma su optimizuotu vektoriaus naudojimu pasižymi pranašumu, pavyzdžiui, mažesne citokinų audra rizika arba geresniu saugumu sisteminėse injekcijose.
Vertinant translacinį potencialą, taip pat buvo analizuojamos biodistribucijos ypatybės: kaip CAR-iNK ląstelės pasklinda organizme, kiek laiko jos išlieka cirkuliacijoje, ar pasiekia kaulų čiulpus ar kitas leukemijai svarbias nišas. Tokie duomenys yra būtini ruošiant preklinikinę medžiagą reguliatoriams ir planuojant saugumo bei dozavimo strategijas vėlesniuose animaliniuose ar ankstyvuose žmogaus tyrimuose. Galiausiai, gerai suderintas santykis tarp taupomo vektoriaus kiekio ir išlaikomo funkcionalumo stiprina argumentą dėl tolesnių investicijų į CLIA/GMP lygiu vykdomus bandymus ir klinikinius įvertinimus.
Kodėl tai svarbu ląstelių terapijos vystymui
Virusiniai vektoriai (pvz., lentivirusai, retrovirusai) yra vieni brangiausių komponentų CAR ląstelių gamyboje. Išskirtinis jų pranašumas yra patikimas genų perdavimas ir, dažnai, ilgalaikė ekspresija, tačiau jų gamyba, titravimas ir saugus tvarkymas reikalauja specializuotų pajėgumų ir didelių investicijų. Sumažinus reikalingą virusinio vektoriaus kiekį keliomis eilėmis, tiesiogiai sumažėja vieneto gamybos kaina, taikomosios saugos procedūros tampa paprastesnės ir mažiau resursų reikalaujančios, o tai savo ruožtu sumažina rinkos prieigos barjerus.
Toks pokytis ypač aktualus NK ląstelių terapijų kontekste. NK ląstelės natūraliai pasižymi gebėjimu atpažinti ir sunaikinti virusų užkrėstas arba navikines ląsteles be išankstinio antigeno pristatymo, o CAR modifikacija gali suteikti didesnį tikslumą ir stipresnį aktyvavimą prieš konkrečius naviko antigenus, pavyzdžiui, CD19. Naujasis metodas suteikia galimybę plėsti „off-the-shelf“ CAR-iNK produktų kūrimą: universalios, paruoštos naudoti ląstelės gali būti gaminamos didelėmis partijomis ir laikomos kaip atsargos, prieinamos gydymui be sudėtingo individualaus paciento ląstelių paruošimo.
Be to, mažesnis vektoriaus poreikis leidžia mažinti biosaugos reikalavimus gamybos patalpose: mažesnės vektorių koncentracijos reiškia mažesnę operatorių ir aplinkos užteršimo riziką, supaprastintus izoliacijos sprendimus ir galimybę efektyviau naudoti esamus GTP/GMP įrenginius. Tai gali sumažinti tiek pradinį kapitalo poreikį, tiek veiklos išlaidas, skatindama mažesnes institucijas ir biotechnologijų įmones įsitraukti į translacinį darbą. Vis dėlto svarbu pažymėti, kad reguliaciniai reikalavimai dėl saugumo ir kokybės išliks griežti: bet koks naujas gamybos būdas privalo būti tinkamai validuotas ir demonstruoti atitikimą geros gamybos praktikos reikalavimams.
Gamybos mastelio didinimas yra viena iš didžiausių kliūčių ląstelių terapijoms tapti plačiai prieinamomis. Modeliai, kurie leidžia sumažinti brangias žaliavas, tokių kaip virusiniai vektoriai, kartu su geresniu procesų valdymu, gali sukurti reikšmingą konkurencinį pranašumą. Tokios optimizacijos taip pat gerina prieinamumą globaliai: mažesnės gamybos sąnaudos reiškia didesnį tikimybę, kad į gydymo protokolus galės įsitraukti sveikatos sistemos su ribota biudžetu arba mažiau išsivysčiusiose rinkose.
Pasekmės ir tolesni žingsniai
Nors gauti rezultatai yra preklininiai, jie atskleidžia kelią link efektyvesnės CAR inžinerijos, kuri išlaiko terapinę galią. Kitas žingsnis bus išsamus metodo saugumo, stabilumo ir veiksmingumo įvertinimas didesniuose gyvūnų modeliuose ir ankstyvuose žmogaus tyrimuose. Būtinai reikės išnagrinėti ląstelių ilgalaikį išgyvenamumą, galimą imuninį atsaką prieš transplantuotas ląsteles, CAR ekspresijos stabilumą ir bet kokius ilgesnės trukmės toksinius reiškinius.
Reguliacinė perspektyva reikalauja kruopščios dokumentacijos: gamybos proceso atkartojamumo (reproducibility), partijos kokybės kontrolės (QC) rodiklių ir saugos profilių turės būti pateikta taip, kad leidžtų pereiti iš preklinikos prie klinikinių etapų. Pasiekus sėkmę pirmuosiuose fazės I/II tyrimuose, gali atsirasti galimybė kurti komerciškai prieinamus „off-the-shelf“ CAR-iNK produktus, skiriamus CD19 ir kitiems navikų antigenams. Reikšminga, kad toks sprendimas gali papildyti arba tam tikrose indikacijose pakeisti CAR-T terapijas, ypač kai kalbama apie gydymą tais atvejais, kur sudėtinga paruošti paciento ląsteles arba kai svarbus greitas prieinamumas.
Galiausiai, mokslininkų bendruomenei bus svarbu bendrinti metodologinius detalius parametrus ir suteikti galimybes nepriklausomam atkartojimui. Tai apima reagento aprašymus, kultūros ir indukcijos sąlygas, transdukcijos laiko langus ir bet kokius modulius, kurie pagerina CAR integraciją iNK ląstelėse. Tokia atvirumo praktika pagreitintų translaciją ir padidintų tikimybę, kad ši optimizacija taps nauju etalonu NK ląstelių immunoterapijų gamyboje.
Apibendrinant, ši inovacija reprezentuoja reikšmingą žingsnį link prieinamesnių ir mastelį palaikančių CAR-iNK terapijų. Jei tolesni tyrimai patvirtins dabartines išvadas, klinikai gali netrukus turėti ekonomišką, paruoštą naudoti NK ląstelių platformą, skirtą CD19 ir kitiems navikų antigenams taikyti. Tokia perspektyva gali ženkliai pakeisti onkologinių imunoterapijų lauką, didinant pacientų prieigą prie pažangių gydymo metodų ir mažinant gydymo kaštus.
Šaltinis: scitechdaily

Palikite komentarą