7 Minutės
Tyrėjai atrado netikėtą kelią, kaip sukurti insulino gaminančias ląsteles: perprogramuojant žmogaus skrandžio audinį. Naudodami laboratorijoje išaugintus skrandžio organoidus ir genetinį „jungiklį“, mokslininkai pavertė gastrines ląsteles į beta tipo panašias ląsteles, kurios gali išskirti insuliną ir padėti reguliuoti gliukozės kiekį kraujyje diabetinėse pelių modeliuose.
Iš skrandžio organoidų — į insuliną gaminančias fabrikus
Cukrinis diabetas 1 tipo atsiranda, kai kasa praranda arba sunaikinamos specializuotos beta ląstelės, gaminančios insuliną, todėl pacientai tampa priklausomi nuo viso gyvenimo trukmės insulino injekcijų ir gliukozės stebėjimo. Norint pakeisti prarastas beta ląsteles, mokslininkai tyrinėjo įvairius kelius — nuo kamieninių ląstelių kilmės salelių iki donorinių transplantacijų — tačiau kiekvienam metodui būdingi kliūčių rinkiniai, kaip imuninė atmetimo rizika, ribotas donorų audinių kiekis ir sudėtinga gamyba.
Dabar tarptautinė tyrėjų grupė, vadovaujama Xiaofeng Huang (Weill Cornell Medicine, JAV) ir Qing Xia (Peking universitetas, Kinija), pritaikė išradingą alternatyvą: pasinaudoti jau organizme esančiomis ląstelėmis. Remdamiesi ankstesniais pelių eksperimentais, mokslininkai išaugo miniatiūrinius žmogaus skrandžio modelius — organoidus, kurie atkuria svarbias gastrinio audinio savybes. Tuomet jie įvedė programuojamą genetinių veiksnių rinkinį — veiksmingai „jungiklį“ — kuris aktyvavus gali nuprogramuoti skrandžio ląsteles į beta tipo panašią tapatybę.
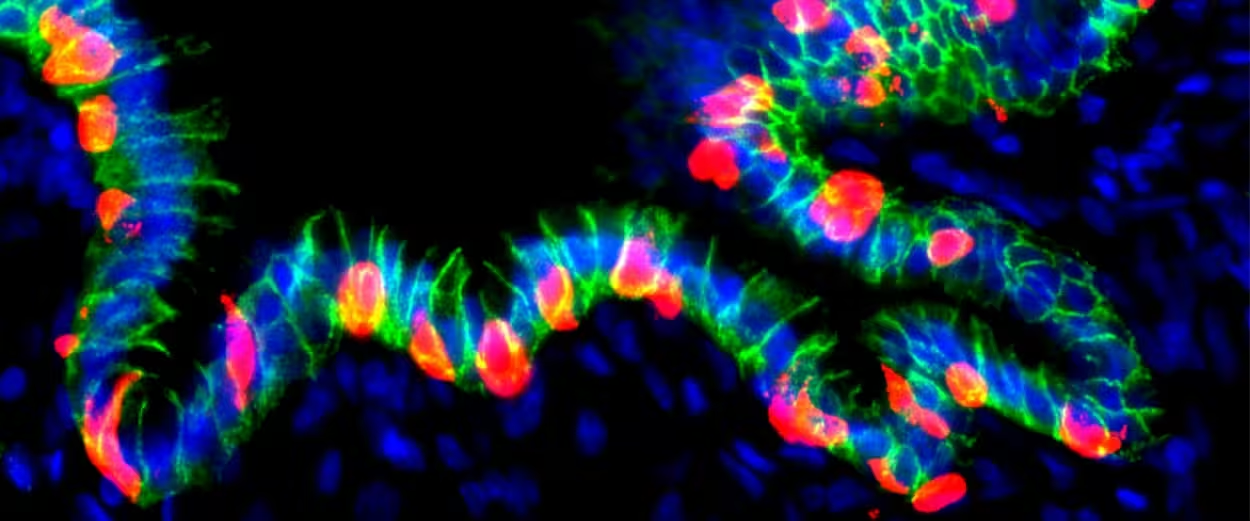
Grafted hGO-NPM generates insulin+ cells
Kaip vyko perprogramavimas
- Komanda in vitro kultivavo žmogaus skrandžio organoidus, gauti atsinaujinantį ląstelių šaltinį.
- Organoidai buvo genetiškai inžineruoti su valdomu programu, kuris suaktyvina beta ląstelėms būdingus genus ir baltymus.
- Transplantavus šiuos inžinerinius organoidus į pelių pilvo ertmę, audiniai susijungė su vietiniais kraujagyslių tinklais ir išliko gyvybingi mėnesiams.
- Kai jungiklis buvo įjungtas, iš žmogaus kilę gastriniai ląstelės pradėjo gaminti insuliną ir rodė genų bei baltymų žymenis, panašius į pankreatines beta ląsteles.
Šiame eksperimente įvairūs technologiniai sprendimai buvo derinami tam, kad būtų įvertinta tiek ląstelių identiteto pakitimo kokybė, tiek jų funkcinė atsako į gliukozę sparta. Genetinė programa, kurią aktyvino mokslininkai, apėmė transkripcinius faktorius ir reguliatorinius elementus, žinomus iš kasos beta ląstelių biologijos, siekiant užtikrinti, kad perprogramuotos ląstelės ne tik išreikštų insulino geną, bet ir teisingai apdorotų bei išskirtų insuliną reaguodamos į glikeminius signalus.
Eksperimentų metu tyrėjai naudojo kelis validacijos sluoksnius: molekulinius žymenis (pvz., INS, PDX1, NKX6.1, MAFA), baltymų lokalizaciją imunohistochemijoje, ir funkcinius testus, tokius kaip glukozės stimuliacijos izoliacijose bei gyvų gyvūnų metabolinių atsakų stebėjimas. Visi šie rodikliai padėjo nustatyti, ar perprogramuotos skrandžio ląstelės iš tikrųjų įgauna beta ląstelių panašias savybes, o ne tik trumpalaikę transkripcijos eigos perturbaciją.
Kodėl tai svarbu 1 tipo cukriniam diabetui
Diabetinėse pelėse insulinas, išskiriamas perprogramuotų žmogaus skrandžio ląstelių, padėjo reguliuoti gliukozės koncentraciją ir pagerino simptomus — tai yra esminis koncepcijos įrodymas. Tokie rezultatai rodo, kad perprogramuotos ląstelės gali atlikti fiziologinę funkciją in vivo ir prisidėti prie gliukozės homeostazės atstatymo.
Vienas iš svarbių šio metodo privalumų yra skrandžio audinio prieinamumas: skrandžio epitelis pasiekiamas minimaliai invazinėmis procedūromis, pavyzdžiui, endoskopija, todėl teoriškai gali būti įmanoma perprogramuoti paciento pačių ląsteles vietoje (in situ). Tai reikšmingai sumažintų priklausomybę nuo donorinių ląstelių, mažintų imuninės atmetimo riziką ir supaprastintų logistiką, susijusią su ląstelių terapija.
Tačiau reikšmingos kliūtys išlieka. Autoriai savo rezultatus publikuoja žurnale Stem Cell Reports (lapkričio 6 d.), ir jie pabrėžia, kad saugumas, ilgaamžiškumas ir ilgalaikė funkcija turi būti patvirtinti prieš pradedant žmonių tyrimus. Svarbūs klausimai apima perprogramavimo kontrolės tikslumą, netyčinio nenormalaus ląstelių elgesio (pvz., proliferacijos ar dediferenciacijos) prevenciją, bei mechanizmus, kurie užtikrintų, jog imuninė sistema nepuls naujai atsiradusių insulino gamintojų.
Be to, reikia atkreipti dėmesį į autoimuninio pobūdžio tiekimo problemą: 1 tipo cukrinius pacientus ir toliau puola autoimuniniai mechanizmai, kurie iš pradžių sunaikino kasos beta ląsteles. Todėl net jei naujos insulino gaminančios ląstelės būtų sukurtos vietoje, reikėtų sukurti apsaugos strategijas, kurios apsaugotų jas nuo to paties imuninio išpuolio. Galimos priemonės apima vietinę imunosupresiją, ląstelių kapsuliavimą, genetinę modifikaciją slopinančią antigens arba tolerogenezės skatinimą.
Ką parodo įrodymai ir kaip vertinti rezultatus
Vertinant tokius perprogramavimo tyrimus, svarbu naudoti kelias nepriklausomas metrikas. Molekulinės analizės (pvz., transkriptomos profilis) turėtų būti palyginamos su natūraliais pankreatinių beta ląstelių profilių šablonais, o funkciniai testai — įvertinti gliukozės jutiklį ir insulino išsiskyrimo dinamiką. Taip pat būtina patikrinti, ar perprogramuotos ląstelės reaguoja normaliais greičiais ir atkuria homeostazinę funkciją, pavyzdžiui, sumažina hiperglikemiją ilgalaikėje perspektyvoje ir sumažina diabeto komplikacijų riziką gyvūnų modeliuose.
Preklininiuose modeliuose svarbūs rodikliai apima ne tik trumpalaikį gliukozės lygio normalizavimą, bet ir laiko matmenį — kiek mėnesių ar metų išliks funkcija, ar ląstelės išvengs de-diferenciacijos ar transformacijos, ir ar implantatai nesukels uždegiminių ar onkologinių komplikacijų. Tokie aspektai yra ypač svarbūs klinikiniam vertinimui ir reguliavimo institucijų reikalavimams.
Regulatorytės ir saugos problemos
Keliai į kliniką apima griežtą saugumo peržiūrą: genų inžinerija turi būti atlikta minimaliu rizikos profiliu (mažai off-target efektų), o naudojamos vektorių sistemos — gerai apibrėžtos. Be to, reikalingi ilgi stebėjimo periodai, histologinis audinių įvertinimas ir imunologiniai tyrimai, užtikrinantys, kad perprogramuotos ląstelės nesukelia nepageidaujamų reakcijų. Atitiktis geros gamybos praktikai (GMP) ir etiniai klausimai dėl genų modifikacijos pacientų ląstelėse yra papildomi žingsniai, kurie lemia tyrimo kelrodę nuo laboratorijos iki ligoninės palatos.
Kas laukia toliau: kryptys ir iššūkiai
Ateities darbai sutelks dėmesį į genetinio „jungiklio“ tobulinimą, ilgesnio išlikimo ir funkcijos testavimą, bei strategijų kūrimą, kurios apsaugotų perprogramuotas ląsteles nuo autoimuninio užpuolimo, būdingo 1 tipo cukriniam diabetui. Taip pat bus svarbu išsiaiškinti, ar perprogramavimas gali būti pakartotinai atliktas vietoje endoskopijos ar panašių minimaliai invazinių procedūrų metu, ar geriau kurti paruoštus, laboratorijoje paruoštus implantus.
Jei metodas pasiteisins, skrandžio perprogramavimas galėtų papildyti kitas regeneracines strategijas — tokias kaip kamieninių ląstelių kilmės salelės, kapsuliavimo technologijos ar imunomoduliuojančios terapijos — sudarant platų priemonių pasirinkimą, skirtą fiziologinei insulino gamybai atkurti. Svarbu pabrėžti, kad kiekvienas iš šių metodų turi unikalių privalumų ir apribojimų, todėl plataus spektro sprendimai greičiausiai apims kelių technologijų derinį.
Taktiniai žingsniai, kurie tikėtini artimiausioje ateityje, apima: optimizuoti transkripcinius faktorius ir jų ekspresijos lygius; ištirti alternatyvius genu pristatymo būdus (pvz., saugesnius vektorius ar neredaguojančias RNR sistemas); įvertinti ilgalaikės apsaugos nuo imuninės atakos metodus; ir plėsti tyrimus į didesnius gyvūnų modelius bei, galiausiai, planuoti saugumo orientuotus žmogaus tyrimus.
Šiuo metu ši studija pateikia intriguojantį koncepcijos įrodymą: skrandis, paprastai nesusijęs su gliukozės reguliavimu, gali būti pritaikytas kaip insulino šaltinis. Toks perspektyvos pasikeitimas atveria naujas galimybes ląstelių pagrindu grindžiamoms diabetui gydyti terapijoms ir pabrėžia kūrybiškus mokslininkų požiūrius, kurie siekia įveikti lėtines ligas.
Tolimesni tyrimai turės subalansuoti inovacijų tempą su griežtu saugumo vertinimu, kad bet kokia translacinė kelionė į pacientus būtų paremtą tvirtais duomenimis ir etiška klinikine praktika. Siekiant praktinių protrūkių, tarpdisciplininis bendradarbiavimas tarp molekulinės biologijos, regeneracinės medicinos, imunologijos, biotechnologijų inžinerijos ir klinikinių specialistų bus esminis. Tai leis ne tik tiksliau suprasti technines detales, bet ir užtikrinti, kad naujos terapijos būtų saugios, prieinamos ir efektyvios pacientams su 1 tipo cukriniu diabetu.
Šaltinis: scitechdaily

Palikite komentarą