6 Minutės
Mokslininkai nustatė vieną geno variantą, sukeliantį itin retą naujagimių diabetą — atradimą, kuris atskleidžia daugiau įžvalgų apie tai, kaip susiformuoja ir degraduoja insulino gamybai atsakingos beta ląstelės. Ši mutacija slopina beta ląstelių funkciją ir gali lemti jų mirtį, kas paaiškina trikdančią simptomų trijulę, pastebėtą paveiktuose kūdikiuose: diabetą, mikrocefaliją ir dažną epilepsiją. Tokie genetiniai radiniai padeda suprasti ląstelių biologiją, ligos mechanizmus ir galimų gydymo priemonių krypį tiek retoms, tiek dažnesnėms diabeto formoms.
One gene, a devastating childhood syndrome
Tarptautinė tyrėjų grupė susiejo naujagimių diabetą šešiuose kūdikiuose su mutacijomis TMEM167A gene. Šie naujagimiai taip pat sirgo mikrocefalija (proporcingai mažesne kaukole) ir, penkiuose iš šešių atvejų, epilepsija — rinkinys simptomų, jau apibrėžiamas kaip MEDS (microcephaly, epilepsy, and diabetes syndrome). Iki šiol MEDS buvo tiesiogiai susijęs tik su dviem genais (IER3IP1 ir YIPF5); nauji duomenys patvirtina TMEM167A kaip trečią genetinę MEDS priežastį. Šis atradimas papildo genetinės diagnostikos žinias ir išplečia sąrašą genų, kuriuos reikia tirti, kai klinikinis vaizdas nurodo mikrocefaliją, epilepsiją ir ankstyvą diabetą.
How TMEM167A undermines insulin production
TMEM167A genas aktyvus tiek kasoje, tiek smegenyse tiek žmonėms, tiek pelėms — toks raiška paaiškina, kodėl genetinė mutacija veikia abu organus ir lemia tiek neurologinius, tiek metabolinius simptomus. Norėdami ištirti mutacijos poveikį, mokslininkai redagavo žmogaus pluripotentines kamienines ląsteles: įprastą TMEM167A geno variantą pakeitė tuo, kuris buvo nustatytas MEDS pacientui. Tada šias kamienines ląsteles nukreipė link kasos beta ląstelių diferenciacijos — t. y. sukūrė specializuotas beta ląsteles, gebančias gaminti ir išskirti insuliną. Tokie kamieninių ląstelių modeliai leidžia reprodukuoti ir tirti genetinius pakeitimus saugioje laboratorinėje aplinkoje, suteikiant galimybę tyrinėti molekulinius mechanizmus, kurie kitu atveju būtų nepasiekiami žmogaus audiniuose.
Development looks normal — function does not
Nustebino tai, kad beta ląstelės, turinčios TMEM167A variantą, morfologiškai susiformavo ir jų skaičius atrodė panašus į įprastą, tačiau šios ląstelės buvo funkcionaliai nepakankamos. Reaguodamos į gliukozės poveikį, jos nesugebėjo tinkamai išskirti insulino, kaip daro sveikos beta ląstelės. Funkcinis gedimas buvo susijęs su streso padidėjimu endoplazminiame tinklelyje (ER) — ląstelės baltymų pažaidimo ir transporto sistemoje. Nuolatinis ER stresas aktyvavo signalo kelius, kurie galiausiai sužadino programuotą ląstelių mirtį (apoptozę) arba kitus degeneracinius procesus, dėl kurių beta ląstelės nyko. Iš esmės, nors vystymosi fazėje beta ląstelės atrodė „normalios“, jų gebėjimas lokalizuotai gaminti ir išskirti insuliną buvo smarkiai susilpnintas dėl ląstelinio streso ir susijusių signalinių grandinių, kurios pažeidė endokrininės funkcijos palaikymą.
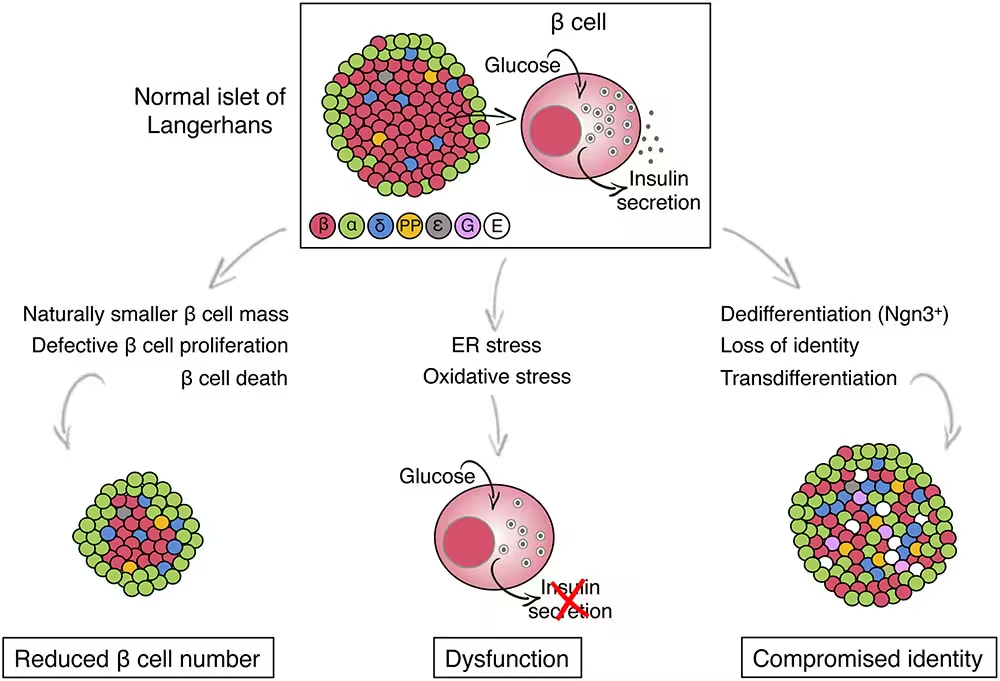
„Galimybė iš kamieninių ląstelių generuoti insulino gaminančias ląsteles leido mums ištirti, kas konkrečiai neveikia beta ląstelėse pacientų, sergančių retomis formomis ir kitomis diabeto rūšimis,“ paaiškino diabetologė Miriam Cnop iš Bruselio Laisvojo universiteto (Free University of Brussels). „Tai išskirtinis modelis, leidžiantis tirti ligos mechanizmus, identifikuoti molekulinius trūkumus ir testuoti būsimas gydymo strategijas, skirtas sumažinti ER stresą ar atstatyti insulino sekreciją.“ Jos komentarai akcentuoja kamieninių ląstelių modelio privalumus tyrimų metodikoje, nes šie modeliai suteikia ne tik diagnostinės informacijos, bet ir eksperimentinį lauke, kuriame galima išmėginti farmakologinius junginius bei genų redagavimo sprendimus.
Why this matters beyond rare disease
Nors MEDS yra labai reta būklė (iki šio tyrimo buvo registruoti tik apie 11 atvejų), ląsteliniai sutrikimai — ER stresas, nepavykusi insulino sekrecija ir beta ląstelių praradimas — atitinka procesus, pastebimus ir dažnesnėse diabeto formose, ypač II tipo diabete. Tokia sutampanti patologija reiškia, kad tyrimai apie TMEM167A ir su juo susijusius mechanizmus gali turėti platesnį poveikį diabeto mokslui: nuo potencialių terapinių taikinių identifikavimo iki kamieninių ląstelių pagrindu sukurto beta ląstelių atstatymo strategijų tobulinimo. Mokslinės įžvalgos į ER stresą ir baltymų apdorojimo defektus gali padėti sukurti naujas vaistų klases arba derinius, kurie sumažintų beta ląstelių pažeidžiamumą ir pagerintų insulino gamybą pacientams su įvairiomis diabeto formomis.
„DNA pokyčių, kurie sukelia diabetą naujagimiams, suradimas suteikia unikalią galimybę identifikuoti genus, kurie atlieka svarbų vaidmenį insuliną gaminančių ląstelių formavime ir sekrecijoje,“ sakė molekulinė genetikė Elisa de Franco iš Exeterio universiteto (University of Exeter). „Mūsų darbas paaiškina, kaip mažai žinomas TMEM167A genas yra būtinas insulino sekrecijai.“ Tokios autoritetingos pastabos rodo, kad net reti genetiniai sindromai gali atskleisti pagrindinius biologinius mechanizmus, svarbius plačiajai medicinos bendruomenei, ir padėti nukreipti tolimesnius funkcinius tyrimus bei įgyvendinti potencialias terapines priemones ateityje.
Looking ahead: diagnosis and potential therapies
Klinikiniu požiūriu TMEM167A mutacijų atpažinimas leidžia pateikti galutinę genetinę MEDS diagnozę, kas yra svarbu šeimos konsultavimui, paveldimumo vertinimui ir tiksliai naujagimių priežiūrai. Genetinė diagnozė suteikia tikslesnę prognostinę informaciją, leidžia pritaikyti medicininį stebėjimą ir parinkti priemones neurologiniams simptomams (pvz., epilepsijai) valdyti. Tyrimų lauke kamieninių ląstelių modelis dabar veikia kaip eksperimentinė platforma, kurioje galima išbandyti junginius, kurie mažina ER stresą, slopina degeneracinius signalus arba tiesiogiai skatina insulino sintezę ir sekreciją. Tokie tyrimai padės atrinkti potencialias vaistines medžiagas ir įvertinti jų poveikį beta ląstelių išgyvenamumui bei funkcijai prieš pereinant prie gyvūninių modelių ar klinikinių tyrimų.
Nors perkėlimas nuo fundamentinių atradimų prie realių, pacientams skirtų gydymo metodų gali užtrukti kelerius metus, šis darbas atveria tiesioginį kelią nuo geno identifikavimo prie mechanistinio supratimo — ir galiausiai prie tikslinių intervencijų. Tokios intervencijos galėtų apimti mažinimą ER streso keliuose, taikinių pagal genų ekspresiją modifikavimą, farmakologinį insulino sekreciją skatinantį gydymą arba net genų terapijos sprendimus, nukreiptus į TMEM167A funkcijos atkūrimą. Be to, gilesnės žinios apie TMEM167A funkciją galėtų padėti optimizuoti kamieninių ląstelių terapijas, skirtas beta ląstelių pakeitimui pacientams su įvairiomis diabeto formomis, įskaitant II tipo diabetą, kuriame beta ląstelių disfunkcija ir išsekimas yra reikšmingi ligos progresavimo veiksniai.
Šaltinis: sciencealert

Palikite komentarą